21. CROI 2014 vom 3.-6. März 2014 in Boston
ART und Hepatitis im Fokus
Das Format der CROI (Conference on Retroviruses and Opportunistic Infections) ist über die Jahre gleich geblieben. Rund 4.000 Teilnehmer waren nach Boston gereist, die Hälfte davon waren Amerikaner. Präsentiert wurden rund 1.000 Arbeiten, die Hälfte davon ebenfalls aus Nordamerika. Neu war dagegen das „Erscheinungsbild“ des Kongresses. Das schematische HI-Virus, das die Tagung seit 20 Jahren begleitete, ist verschwunden. Die Webseite hat ein neues Gesicht, das Programm erschien sehr spät und es gab kein gedrucktes Abstract-Buch. Auch im Nachgang ist die Webseite schwierig. Die Suchfunktion ist so rundimentär bzw. nicht vorhanden, dass es leider nicht möglich war, bei allen Arbeiten die entprechende Abstractnummer zu eruieren. Dafür kann man die meisten Vorträge inkl. Slides im Internet ansehen. Der Grund für die Veränderung: Die CROI wird neuerdings gemeinsam von der CROI Foundation und der IAS-USA organisiert. Ein Vorteil hat diese Neuerung auf jeden Fall. Der Termin der nächsten CROI steht fest. Die CROI 2015 wird am 23.-26. Februar in Seattle stattfinden.
Duale Therapie auf dem Prüfstand
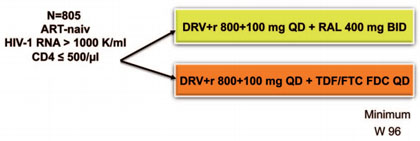 Abb. 1 NEAT: Studiendesign (nach Raffi F et al., 84LB)
Abb. 1 NEAT: Studiendesign (nach Raffi F et al., 84LB)
In kleineren Untersuchungen hat sich die Nuke-freie sprich
duale Firstline-Therapie schon bewährt. Jetzt wurde sie in der großen
europäischen NEAT-Studie nach allen Regeln der wissenschaftlichen Kunst
geprüft. 800 therapienaive Patienten wurden mit Darunavir/r (DVR/r) 800 mg OD
plus Raltegravir (RAL) BID oder Tenofovir/Emtricitabin (TDF/FTC) OD behandelt
(Abb. 1). Endpunkte waren die Zeit bis zum virologischen Versagen definiert als
<1log Reduktion der Viruslast zu Woche 18 oder ≥400 Kopien/ml zu Woche 24
oder ≥50 Kopien/ml nach Woche 32 (jeweils zwei Messungen!) sowie Tod und Aids.
Alle Patienten wurden mindestens 96 Wochen beobachtet. Im Schnitt lag die
Beobachtungsdauer bei 144 Wochen. Die Mehrzahl der Teilnehmer waren weiße
Männer (82% bzw. 88%). Die CD4-Zahl lag bei 330/µl (15% <200/µl), die
Viruslast bei 4,7 log K/ml (35% ≥ 100.000 K/ml).
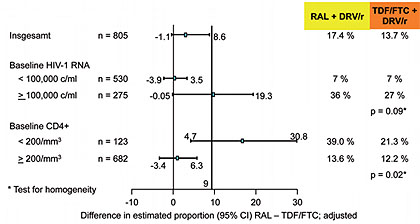 Abb. 2 NEAT: Primärer Endpunkt – Subgruppenanalyse (nach Raffi F et al., 84LB)
Abb. 2 NEAT: Primärer Endpunkt – Subgruppenanalyse (nach Raffi F et al., 84LB)
Ein virologisches Versagen wurde im RAL-Arm bei 19% und im TDF/FTC-Arm bei 15% der Patienten beobachtet, wobei fast alle (nur zwei Ausnahmen) nach Woche 32 versagten. Zu Woche 96 lag die Viruslast bei 93% bzw. 89% der Patienten unter der Nachweisgrenze und die CD4-Zahl war in beiden Gruppen gleichermaßen gestiegen. Einen signifikanten Unterschied zwischen den Regimen gab es allerdings bei den Patienten mit fortgeschrittenem Immundefekt (CD4 <200/µl). Hier versagten im RAL-Arm 39% und im TDF/FTC-Arm 21% (p=0,02) (Abb. 2). Diese Patienten hatten häufiger auch eine hohe Viruslast >100.000 K/ml. Primäre Resistenzmutationen waren insgesamt selten. Im Nuke-Arm wurden gar keine, im Nuke-freien Arm fünf Integrase-Mutationen und eine K65R nachgewiesen. Beide Regime waren gut verträglich. Unter RAL wurde häufiger ein Anstieg von Kreatininkinase und GPT, unter TDF/FTC ein Abfall der Kreatininclearance um 3,8 ml/Min beobachtet (Raffi F et al., 84LB).
Third Agent im Vergleich
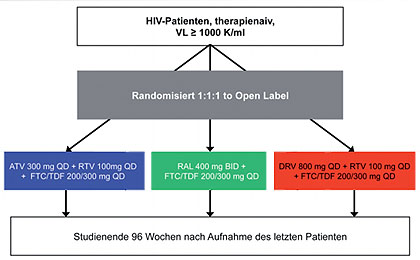 Abb. 3 A5257: Studiendesign (nach Landovitz RJ et al., 8)
Abb. 3 A5257: Studiendesign (nach Landovitz RJ et al., 8)
In dieser großen amerikanischen Studie (n=1805) wurden drei
beliebte Firstline-Regime direkt miteinander verglichen und zwar Atazanavir/r
(ATV/r), Darunavir/r (DRV/r) und Raltegravir (RAL) jeweils in Kombination mit
TDF/FTC als Backbone (Abb. 3). Die
CD4-Zahl der Teilnehmer lag bei rund 300/µl (30% <200/µl), die Viruslast
betrug 4,6 log (30% >100.000 K/ml). Endpunkte waren virologisches Versagen,
Abbruch wegen Unverträglichkeit sowie die Kombination aus beidem. Als
Besonderheit wurden in dieser offenen Studie Patienten nach einem Switch nicht
ausgeschlossen, sondern nahmen weiterhin im anderen Arm an der Studie teil.
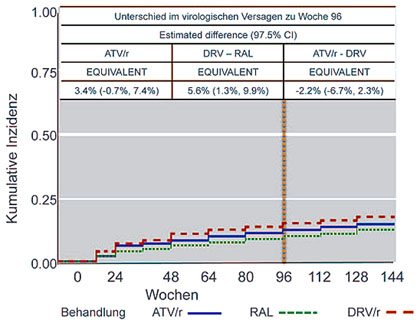 Abb. 4 ACTG 5257 –virologisches Versagen im Verlauf (nach Landovitz RJ et al., 85.)
Abb. 4 ACTG 5257 –virologisches Versagen im Verlauf (nach Landovitz RJ et al., 85.)
Die virologische Wirksamkeit der drei Regime war vergleichbar. Ein virologisches Versagen wurde unter ATV/r bei 13%, unter DVR/r bei 15% und unter RAL bei 10% der Patienten beobachtet (Abb. 4). Primäre Resistenzmutationen waren im RAL-Arm am häufigsten, wobei beide Komponenten des Regimes betroffen waren.
Im Hinblick auf die Verträglichkeit schnitt der Integrasehemmer am besten ab. ATV/r hatten 16% der Patienten abgesetzt und zwar meist wegen einer „kosmetischen Hyperbilirubinämie“. Gastrointestinale Störungen waren der zweithäufigste Grund. Bei Darunavir/r brachen 5% die Behandlung ab mit Magen-Darm-Problemen als häufigste Ursache (Landovitz RL et al., 85). Weitere Subanalysen bezüglich Stoffwechsel, Adhärenz, Knochen usw. sind unterwegs.
Switch-Studien
In der SINGLE-Studie war Dolute-gravir+ABC/3TC nach 96 Wochen dem Regime EFV/TDF/FTC immer noch überlegen. Grund dafür war in erster Linie die bessere Verträglichkeit der erst genannten Option (Walmsley S et al., 543). Im französischen Early Access Programm wurde Dolutegravir bei 13 Patienten mit HIV-2 und Raltegravir-assoziierten Mutationen eingesetzt, teils mit gutem Erfolg (Descamps D et al.).
Der Switch von einem Proteasehemmer-basierten Regime auf die Fixkombination Elvitegravir/TDF/FTC bei supprimierten Patienten in der Studie STRATEGY-PI war virologisch kein Problem. Das Nebenwirkungsprofil bot keine Überraschungen (Arribas J et al., 551LB). Ein ähnliches Ergebnis erbrachte die Studie STRATEGY-NNRTI, in der von einem NNRTI-basierten Regime auf die Elvitegravir-haltige Fixkombination umgestellt wurde (Pozniak E et al., 553LB).
Pipeline neu gefüllt
Es gibt eine neue Substanzklasse in der Pipeline. Der Attachment-Inhibitor BMS-663068 zeigte in einer Phase-2-Studie an vorbehandelten Patienten eine mit einem geboosterten Proteasehemmer vergleichbare Wirkung bei guter Verträglichkeit (Lalerari J et al., 86). Doravirin (früher MK-1439) ist neuer NNRTI, der auch bei einigen NNRTI-Mutationen noch wirksam ist, weniger Interaktionspotential aufweist und weniger ZNS-Nebenwirkungen hat (Morales-Ramirez JO et al., 92LB). Des weiteren wird an Medikamenten mit langer Wirkdauer gearbeitet. In der LATTE-Studie wurden der Integrasehemmer GSK-744 mit einer Halbwertszeit von 40 Stunden bei oraler Gabe geprüft. Voll supprimierte Patienten unter GSK-744 plus 2 NRTI wurden dabei erfolgreich auf eine orale Erhaltungstherapie mit GSK-744 und Rilpivirin umgestellt (Margiolis D et al., 91LB). Diese Untersuchung ist eine Grundlage für die Weiterentwicklung eines injizierbaren Depot-Regimes aus beiden Substanzen. Eine Studie mit der Gabe von jeweils einer Dosis der beiden Medikamente (jeweils 2 ml i.m.) alle vier Wochen ist geplant. Bislang offen blieb die Frage eines Kongressteilnehmers, wie man die Medikation bei solch langen Halbwertszeiten am besten absetzt.
Weiterentwicklung
Atazanavir wird auch in einer mit Cobicistat geboosterten Fixkombination entwickelt. In einer pharmakokinetischen Untersuchung waren die Atazanavir-Spiegel mit den Boostern Ritonavir sowie Cobicistat vergleichbar (Xiaolu T et al.). Bereits im Juli vergangenen Jahres war eine klinische Studie mit 692 Patienten erschienen, die ebenfalls keinen Unterschied zwischen den beiden Boostern in Kombination mit Atazanavir zeigte (Gallant J E et al., J Infect Dis 2013).
Herzinfarkt rückläufig, aber nicht bei Frauen
Die Bedeutung von HIV als Risikofaktor scheint abzunehmen. Laut einer Auswertung der Daten von rund 25.000 HIV-Positiven und 250.000 HIV-Negativen eines amerikanischen Krankenversicherers hatten HIV-Patienten in den Jahren 1996-2010 ein um 40% höheres Infarktrisiko. Seit 2010 ist das Risiko jedoch vergleichbar bzw. sogar etwas geringer aufgrund der besseren Behandlung erhöhter Lipide (Klein DB et al., 737). Anders sieht es bei HIV-positiven Frauen aus. Ihr Risiko ist dreimal höher als das HIV-negativer Frauen (Womack JA et al., 734).
Vor wenigen Jahren wurde auch Abacavir als Risikofaktor für einen Myokardinfarkt diskutiert. Nach Sichtung aller (teils widersprüchlicher) Daten wurde das NRTI „freigesprochen“. Das erhöhte Risiko in der D:A:D-Kohorte sei ein „channeling bias“ gewesen, d.h. es wurden vorzugsweise Patienten mit erhöhtem Herz-Kreislauf-Risiko mit Abacavir behandelt. Dem widerspricht die D:A:D jetzt in einer neuen Analyse. Das Herzinfarktrisiko unter Abacavir sei vor und nach der ersten Publikation 2008 gleichermaßen erhöht, ein channeling bias somit ausgeschlossen (Sabin CA et al., 747LB).
Risikofaktor Poppers
Das inhalative Nitrat Poppers ist bei schwulen Männern sehr beliebt. Bei starkem Gebrauch (einmal pro Woche und mehr) verdoppelt die Substanz das Risiko einer Herz-Kreislauf-Erkrankung bei Nicht-Rauchern. Bei Rauchern überwiegt der Nikotinabusus als Risikofaktor (Holman A et al., 740).
Knochen
Die Auswirkungen der ART und insbesondere von Tenofovir auf
den Knochen werden schon länger diskutiert. In einer amerikanischen
Untersuchung verminderte das Nukleotid die Knochendichte bei Neugeborenen. Die
Knochendichte der 74 Kinder, deren Mütter im dritten Trimester mehr als acht
Wochen Tenofovir eingenommen hatten, war um 6,4 g niedriger als die der 69
Kinder ohne Tenofovir-Exposition (Siberry G et al., 71).
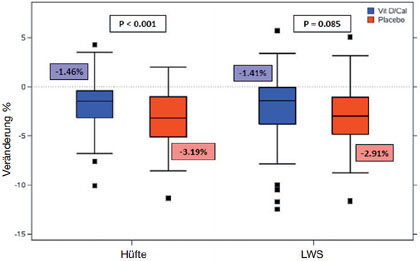 Abb.5 ACTG A5280: Abfall der Knochendichte unter ART plus Vitamin D/Calcium vs. Placebo
Abb.5 ACTG A5280: Abfall der Knochendichte unter ART plus Vitamin D/Calcium vs. Placebo
In den ersten 48-96 Wochen nach Einleitung der ART nimmt die Knochendichte um 2-6% ab. In einer Substudie der ACTG 5752 (n=328) kam es ebenfalls unter allen drei Regimen an allen Messpunkten zum Abfall der Knochendichte, im RAL-haltigen Arm jedoch weniger stark als unter den Proteasehemmer-basierten Regimen (Brown TT et al., 779LB). Ob Vitamin D und Calcium den initialen Knochenverlust aufhalten können, wurde in der Studie ACTG 5280 untersucht. Bei allen 165 Patienten wurde die ART mit TDF/FTC/EFV eingeleitet. Eine Gruppe erhielt zusätzlich Vitamin D 4.000 IU/d plus Calciumcarbonat 1.000 mg/d, die andere Gruppe Placebo. Nach 48 Wochen war es in beiden Gruppen zu einem Abfall des Knochenmineralgehaltes gekommen, jedoch signifikant geringer ausgeprägt in der Verum Gruppe. Unter Vitamin D/Calcium sank die Knochendichte an der Hüfte um 1,5% im Vergleich zu 3% unter Placebo (Abb. 5)(Overtone ET et al., 133).
Krebs
Immungeschwächte haben ein höheres Risiko für bestimmte Krebsarten. Dies trifft für HIV-Positive wie Transplantierte gleichermaßen zu. Doch bei HIV-Patienten wird die Diagnose von Malignomen an Lunge, Prostata, Brust, Haut und Zervix meist erst in späteren Stadien gestellt als bei den Transplant-Patienten. Entsprechend höher ist die Mortalität. Einzige Ausnahme: Beim Analkarzinom haben die HIV-Positiven bessere Chancen bei der Frühdiagnostik und bei der Prognose (Shiels MS et al., 705).
Unklar ist, ob das Krebsrisiko auch bei gut behandelten HIV-Patienten erhöht ist. Die Auswertung des dänischen Krebsregister ergab zwar ein erhöhtes Risiko für die HIV-Positiven (CD4-Zahl 450/µl). Verglich man jedoch nicht-rauchende HIV-Patienten mit der allgemeinen Bevölkerung war das Risiko lediglich für Virus-assoziierte Tumore erhöht (Hellenberg M et al.)
HCV-Therapie: immer kürzer
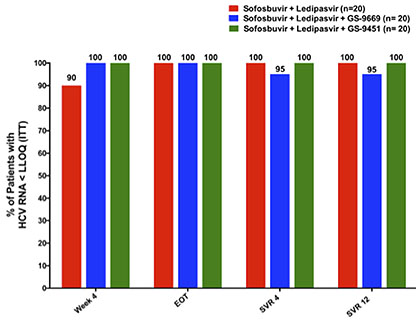 Abb. 6 SVR-Raten unterschiedlicher DAA-Kombinationen (nach Kohli A et al., 27LB. )
Abb. 6 SVR-Raten unterschiedlicher DAA-Kombinationen (nach Kohli A et al., 27LB. )
Eine ganze Session war den
Therapiestudien bei Hepatitis C gewidmet. Die Dynamik in diesem Gebiet ist
atemberaubend, doch nur 10 Wochen nach dem amerikanischen Leberkongress gab es
verständlicherweise nur wenige ganz neue Daten. Besonders spannend ist immer
der Blick in die Zukunft. Die neuen Kombinationen aus zwei bis drei DAA heilen
auch schwer behandelbare Patienten mit GT1 in wenigen Wochen. In der
Pilotstudie SYNERGY vom amerikanischen NIH beispielsweise führte die
3er-Kombination aus Sofosbuvir/Ledipasvir plus ein nn-NS5B-
Hemmer oder ein Proteasehemmer innerhalb von nur sechs Wochen zu einer fast
100%-SVR (Abb. 6) (Kohli A et al., 27LB). Weitere Studien werden folgen, um für
jeden Genotyp und jede Situation die optimale Kombination und optimale
Therapiedauer zu finden.
Einige 3er-Kombinationen sind bereits in der fortgeschrittenen Entwicklung. Daclatasvir, Asunaprevir und BMS-325 beispielsweise zeigte hohe Erfolgsraten bei GT1b, weniger hohe bei GT1a-Patienten mit Zirrhose (Everson GT et al., 25). Die 3er- Kombination aus ABT-450, -267 und -333, die in der Phase-3-Studie PEARL III an GT1b-Patienten geprüft wurde, ist mit und ohne Ribavirin bei einer Therapiedauer von 12 Wochen mit einer SVR-Rate von weit über 90% gleichermaßen erfolgreich – auch bei mit Methadon oder Buprenorphin substituierten Drogenabhängigen (Ferenci P et al., 29LB; Lalazari J et al.).
Proteasehemmer der zweiten Generation
Ein Aspekt wurde in der Hepatitis-Session immer wieder
betont: Die Ergebnisse der Therapie mit DAA bei HIV/HCV-Koinfizierten und
HCV-Monoinfizierten sind vergleichbar. Diese Erkenntnis stammt u.a. aus den
Studien an Koinfizierten mit den HCV-Proteasehemmer. Die Proteasehemmer der
zweiten Generation Faldaprevir und Simeprevir müssen nur einmal täglich ein-genommen
werden und sind deutlich besser verträglich
als ihre Vorgänger
Boceprevir und Telaprevir. Beide Substanzen interagieren mit der ART d.h. ggf.
muss die Dosis (oder die ART) angepasst werden.
Faldaprevir- bzw. Simeprevir wurde bei Koinfizierten 12 Wochen lang als Tripletherapie in Kombination mit pegInterferon und Ribavirin gegeben. Bei frühem Ansprechen wurde 12 Wochen, bei späterem Ansprechen 36 Wochen dual weiterbehandelt.
Rund 80 bzw. 89% der Patienten erreichten ein frühes Ansprechen und bei diesen Patienten lag die SVR-Rate bei 86% bzw. 87%. Subgruppen mit negativen Prädiktoren wie IL28B-nonCC usw. hatten auf die Tripletherapie mit Interferon schlechter angesprochen. Es gab aber auch Überraschungen. So verschlechterten der Polymorphismus Q80K bei Simeprevir und die Zirrhose bei Faldaprevir das Ansprechen nicht – zumindest in diesen Untersuchungen. Die meisten Patienten, die keine SVR erreichten, hatten virologisch versagt und eine Resistenz gegen den Proteasehemmer entwickelt.
Im klinischen Alltag sollte man bei Patienten, die kein frühes Ansprechen erreichen, die Behandlung abbrechen, riet Douglas Dietrich, New York, der beide Studien vorstellte. Die Resistenzentwicklung, die dem fehlenden Ansprechen zugrunde liegt, stellt laut Dietrich kein Problem dar. Man könne mit anderen DAA ohne Kreuzresistenz eine „Salvage“-Therapie machen oder warten bis die Mutationen spontan verschwinden (Dietrich D et al, 23 und 24).
Sofosbuvir ohne Interferon
| Genotyp 1 | Genotyp 2 | Genotyp 3 | |||
| HCV RNA < 25 IU/ml, % |
Naiv 24 W SOF + RBV (n = 114) |
Naiv 12 W SOF + RBV (n = 26) |
Vorbehandelt 24 W SOF + RBV (n = 2) |
Naiv 12 W SOF + RBV (n = 42) |
Vorbehandelt 24 W SOF + RBV (n = 24) |
|---|---|---|---|---|---|
| Wk 4 | 96 | 96 | 100 | 100 | 100 |
| ROT | 100 | 96 | 100 | 98 | 100 |
| SVR12 | 76 | 88 | 92 | 67 | 94 |
| SVR24 | 75 | 88 | 92 | 67 | 88 |
Tab 1 Ergebnisse der Studie PHOTON-1. Ansprech-Raten in Prozent
In der PHOTON-1-Studie wurden HIV/HCV-Koinfizierte mit
verschiedenen Genotypen 12 bis 24 Wochen mit Sofosbuvir/Ribavirin behandelt
wurden. Bei therapienaiven Patienten mit GT1 lag die SVR-Rate nach 24 Wochen
bei 75%. Es hatte zwischen Woche 12 und 24 nach Therapieende einen späten
Relaps gegeben. Bei GT2 waren die SVR-Raten bei 12 Wochen (Naive) und 24 Wochen
(Vorbehandelte) Therapie mit 88% bzw. 92% vergleichbar. Von der längeren
Behandlung über 24 Wochen profitierten insbesondere die GT3-Patienten. Die
SVR-Rate nach 12 Wochen (Naive) ließ sich durch 24 Wochen Therapie
(Vorbehandelte) von 67% auf 94% steigern (Tab. 1) (Naggie S et al., 26).
Akute Hepatitis C
Was ist der Grund für die Zunahme akuter HCV-Infektionen bei HIV-positiven MSM? Eine Auswertung der Schweizer Kohorte deutet auf traumatische Sexpraktiken. Bei der Sequenzanalyse früher HC-Viren fand sich eine Infektion mit mehreren Viren als Ausgangspunkt. Ein Virus als Infektionsauslöser („narrow bottleneck“) spricht für eine sexuelle Übertragung, mehrere Viren („broad bottleneck“) für eine andere Transmission, z.B. Blutkontakt, gemeinsamer Nadelgebrauch usw. (Kouyos R et al., 675). Eine ähnliche Analyse in New York kommt zum gegenteiligen Ergebnis. In den meisten Fällen fand sich dort nur ein „founder virus“(Fierer D et al., 674).
Zweites „Mississippi-Baby“?
Zum Thema Heilung gab es auf dieser CROI keine Sensationen. Ein Durchbruch oder zumindest relevanter Fortschritt ist nicht zu entdecken. Aber es gab ein zweites Mississippi-Baby. Das erste sogenannte Mississippi-Baby ist mittlerweise 41 Monate alt und wird seit 23 Monaten nicht behandelt. Es wird regelmäßig untersucht und immer noch findet sich selbst mit den empfindlichsten Nachweismethoden kein Hinweis auf eine aktive HIV-Vermehrung bzw. ein relevantes HIV-Reservoir. Das zweite Mississippi-Baby wird im Großraum von Los Angeles seit vier Stunden nach der Geburt behandelt. Die Infektion der hochvirämischen Mutter war zum Zeitpunkt der Geburt nicht bekannt. Bei dem Neugeborenen wurde HIV-DNA nachgewiesen und die antiretrovirale Therapie eingeleitet. 32 Stunden nach Therapiebeginn war die Viruslast auf rund 200 K/ml gefallen. Eine Lumbalpunktion am sechsten Tag wegen des Verdachts auf eine bakterielle Infektion ergab 32 HIV-Kopien/ml im Liquor. Wenige Tage später waren im Blut keine Zeichen der HIV-Infektion mehr nachweisbar. Das Baby wird mittlerweile neun Monate antiviral behandelt. Wann die Therapie abgesetzt wird, ist derzeit noch nicht entschieden (Persaud D et al. 75LB). Laut Deborah Persuad, Baltimore, soll die Heilung durch Frühtherapie bei Neugeborenen in einer prospektiven Studie untersucht werden. Die internationale Studie, die in wenigen Monaten startet, wird vom NIH finanziert. Die ART bei 54 Neugeborenen soll nach zwei Jahren abgesetzt werden.
Update „Boston Patienten“
Nach der Heilung des „Berlin Patienten“ wurde auch bei zwei HIV-Patienten in Boston auf Grund einer malignen Erkrankung (Hodgkin bzw. B-Zell-Lymphom) Knochenmark transplantiert. Beide wurden weiter antiretroviral behandelt und bei Patient A war etwa 100 Tage nach der Transplantation in Blut- und Gewebeproben keine HIV-RNA oder -DNA mehr nachweisbar, bei Patient B dauerte es rund 300 Tage.
Die ART wurde bei Patient A nach 4,5 Jahren, bei Patient B nach 2,8 Jahren beendet. In beiden Fällen kam es erneut zur HIV-Replikation, bei Patient A nach 100 Tagen, bei Patient B erst nach 220 Tagen. Die virale Kinetik entsprach dabei einer Erstinfektion, d.h. die Viruslast stieg innerhalb weniger Tage stark. Daraufhin wurde die ART sofort wieder begonnen und die Viruslast sank unter die Nachweisgrenze. Mögliche Gründe für die nicht gelungene Eradikation sind die geringere immunsuppressive Behandlung der Patienten vor der Transplantation und die Gabe von Stammzellen ohne CCR5-Deletion (Heinrich T et al., 144LB).
PreP: TDF oder TDF/FTC?
Die Wirksamkeit der Präexpositionsprophylaxe (PrEP) durch tägliche Einnahme von TDF bzw. TDF/FTC wurde in der Studie Partners PrEP-Studie gesichert. Die Untersuchung wurde 2011 entblindet, da der NRTI-Arm Placebo signifikant überlegen war. Danach wurden die bisherigen Plazebo-Empfänger erneut randomisiert und erhielten nun TDF oder TDF+FTC bis zum Ende der Studie im Dezember 2012. Insgesamt wurden knapp 9.000 Personenjahre ausgewertet. Zwischen TDF und der Fixkombination TDF/FTC bestand kein Unterschied, auch nicht in der Subgruppenanalyse (Beaten J et al., 43).
Keine Transmission unter erfolgreicher ART
Von sechs Jahren sorgte das Swiss-Statement, dass HIV-Positive mit einer Viruslast unter der Nachweisgrenze ohne sexuell übertragbare Erkrankungen beim Sex nicht ansteckend sind, für große Aufregung. Bemängelt wurde unter anderem, dass es kaum Daten für MSM gibt. Diese Lücke wird durch die PARTNER-Studie geschlossen. Die Ergebnisse der ersten geplanten Zwischenauswertung liegen nun vor.
An der europäischen Studie nehmen 1.110 serodiskordante Paare teil. Rund 40% der Paare sind schwule Männer. Der HIV-positive Partner muss behandelt sein, die Viruslast muss <200 Kopien/ml liegen. In der vorgestellten Zwischenanalyse wurden die Daten von 767 Paaren (282 schwule Paare) mit 894 Paarjahren ausgewertet. 16% der Paare wurden von der Analyse ausgeschlossen, da die Viruslast >200 Kopien/ml betrug und 3% weil der HIV-negative Partner PEP oder PrEP einnahm.
Von den schwulen HIV-negativen Männern hatten 34% mit einer
dritten Person ungeschützten Sex, bei den Heterosexuellen waren es 4%. Eine
sexuell übertragbare Infektion wurde bei 16% der schwulen Paare und bei 5% der
heterosexuellen Paare festgestellt.
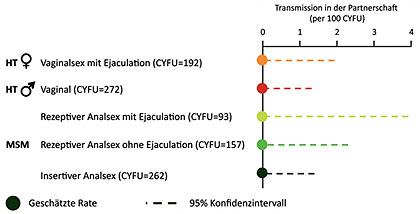 Abb. 7 Statistisches Risiko einer HIV-Transmission. Je nach sexueller Praktik (nach Rodger A, et al., 153LB)
Abb. 7 Statistisches Risiko einer HIV-Transmission. Je nach sexueller Praktik (nach Rodger A, et al., 153LB)
Innerhalb der zweijährigen Beobachtungszeit kam es zu 16.400 homosexuellen und 14.000 heterosexuellen Kontakten. Es kam zu keiner einzigen HIV-Übertragung in der Partnerschaft. Es wurden zwar neue HIV-Infektionen festgestellt (wie viele wird erst am Ende der Studie 2017 bekannt gegeben), doch die Ursache war eine Transmission außerhalb, d.h. der HIV-negative Partner hatte sich bei einer dritten Person angesteckt.
Die statistische Unsicherheit durch das 95-Prozent-Konfidenzintervall errechnet ein potentielles Risiko für ungeschützten Analverkehr von 5%, d.h. einer von 10 HIV-Negativen, könnte sich infizieren, wenn alle 10 Personen 10 Jahre lang ungeschützten Analsex mit ihrem erfolgreich behandelten HIV-positiven Partner haben (Abb. 7) (Rodger A et al., 153 LB).

| Foto: © Ramona Pauli, München | Fotos: © Andrea Warpakowski, Itzstedt |










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
