Internationaler Leberkongress, Easl, 22.-26. April In Wien
Heilung für (fast) alle!

Die 50. Jahrestagung der EASL stand ganz im Zeichen des Erfolges der Hepatitis C Therapie. Nahezu alle Patientengruppen können geheilt werden, und zwar meist innerhalb von 12 Wochen und auch unter Alltagsbedingungen. Durch die zweite Welle direkt antiviraler Medikamente soll die Behandlung noch effektiver, einfacher und kürzer werden.
Der Jahrestagung der Europäischen Lebergesellschaft EASL ist das Highlight des hepatologischen Jahres. Es waren über 10.000 Besucher nach Wien gereist, dennoch blieb der Rekord aus. Erstmals waren es weniger Teilnehmer als im Vorjahr. Die wissenschaftliche Qualität des Kongresses hat dies aber nicht beeinträchtigt.
Im Mittelpunkt des Kongresses stand – wie zu erwarten war – die Therapie der Hepatitis C. Es gab viele Daten aus „real world“ Kohorten, viele Studien mit den zugelassenen Medikamenten (auch mit „schwierigen“ Patientengruppen), einige große Studien zur nächsten Medikamenten-Generation und auch einige Daten zu ganz neuen Substanzen.
Niereninsuffizienz
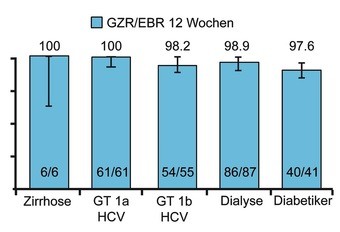
Abb. 1 C-SURFER: Grazoprevir/Elbasvir 12 Wochen. SVR12-Raten (%)
Erstmals wurden Studien an Patienten mit fortgeschrittener Niereninsuffizienz präsentiert. In RUBY-1 werden derzeit 20 Patienten (13 Dialyse) mit dem 3D-Regime Paritaprevir/r/Ombitasvir + Dasabuvir behandelt. Patienten mit GT1a (n=65) erhalten zusätzlich 200 mg Ribavirin jeweils 4 Stunden vor der Dialyse. Die 3D-Medikation, die über die Leber metabolisiert wird, kann unabhängig von der Dialyse gegeben werden. Die HCV-RNA fiel unter der Behandlung rasch ab. Alle 20 Patienten sind derzeit virusfrei und 10 haben die SVR4 erreicht. Die Verträglichkeit der Medikation ist gut. Probleme bereitet lediglich Ribavirin, doch nur bei einem Patienten fiel das Hämoglobin <8 g/dl (Pockros PJ et al., #L01). Im Rahmen von C-SURFER wurden 235 Patienten mit Niereninsuffizienz 12 Wochen mit der neuen pangenotypischen Kombination Grazoprevir/Elbasvir ohne Ribavirin behandelt. 75% der Patienten waren an der Dialyse, fast alle hatten GT1, einige waren vorbehandelt und einige hatten eine Zirrhose. Die SVR-Rate lag bei 94%, die Verträglichkeit war sehr gut (Abb. 1) (Roth D et al., #LP02). Der Einsatz von Sofosbuvir ist bei einer GFR <30 ml/Min laut Fachinformation kontraindiziert. In der Kohorte HCV-Target wurde Sofosbuvir dennoch eingesetzt – mit gutem Erfolg. Allerdings nahm die Häufigkeit renaler Nebenwirkungen zu (Saxena V et al., #LP08). Wegen der möglichen Akkumulation des Metaboliten wird daher auch weiterhin der Einsatz von Sofosbuvir bei eGFR <30 ml/Min nicht empfohlen.
Dekompensierte
Leberzirrhose
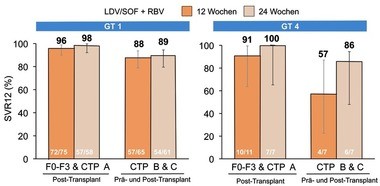
Abb. 2 SOLAR-2: Sofosbuvir/Ledipasvir + Ribavirin bei dekompensierter Zirrhose bzw. nach Lebertransplantation. SVR12-Raten (%). Manns M et al., #G02
Zur
Therapie bei dekompensierter Leberzirrhose wurden zwei größere
Studien präsentiert, die aufgrund des unterschiedlichen Schweregrads
der Lebererkrankung kaum vergleichbar sind. In SOLAR-2 (GT 1/4)
wurden Patienten mit Zirrhose (CPT A-C, CPT <13) oder nach
Transplantation 12/24 Wochen mit Sofosbuvir/Ledipasvir + Ribavirin
behandelt. Die vorläufige Auswertung ergab eine SVR-Rate bei GT1 von
85-88% bei dekompensierter Zirrhose und 95-98% nach
Lebertransplantation, wobei 12 und 24 Therapiedauer einen
vergleichbaren Effekt hatte. Beim Genotyp 4 schnitt die längere
Therapiedauer besser ab (86% vs. 57%), die Patientenzahl war
allerdings sehr klein (Abb. 2) (Manns M et al., #GO2). In ALLY-1
wurde 12/24 Wochen lang mit Daclatasvir + Sofosbuvir mit/ohne
Ribavirin behandelt. Die SVR-Rate war bei allen Genotypen hoch, nahm
allerdings mit dem Grad der Zirrhose ab. Bei den Transplantierten mit
der geringsten Zirrhose lag sie bei 94%, bei den Zirrhotikern
insgesamt bei 84%, bei den Schwerstkranken mit CPT C fiel sie jedoch
auf 56%. Wichtigster negativer Prädiktor war zudem ein Albumin unter
2,8 g/dl (Abb. 3) (Poordad F et al., #LO8).
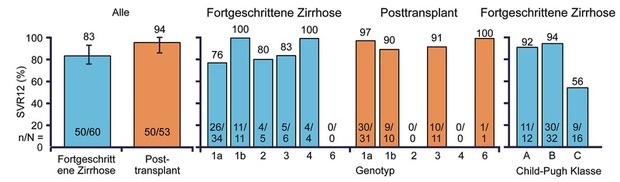
Abb. 3 ALLY-1: Sofosbuvir + Daclatasvir + Ribavirin 12/24 Wochen. SVR12-Raten (%)
Nach der SVR besserte sich der MELD-Score in der Regel aufgrund eines Abfalls des Bilirubins und Anstiegs von Albumin. Dies ist nach Worten von Fred Poordad, Houston, allerdings ein zweischneidiges Schwert, denn da der Patient trotz besserem MELD immer noch eine Transplantation braucht, rückt er wegen der Verbesserung auf der Transplantations-liste weiter nach hinten. Bei einigen wenigen Patienten kam es zudem zu einer Verschlechterung des MELD-Scores.
Klinischer Alltag
Keine gute Idee: E-Poster
Der konsequente Weg der EASL zum papierlosen Kongress ist diesmal allerdings auf heftigen Widerstand gestoßen. Nicht nur Programm und Abstracts gibt es lediglich elektronisch, in diesem Jahr waren auch die Poster nur noch an einem Monitor zu sehen. Konkret heißt das, man muss sich einen freien Monitor suchen (Wartezeit!), man muss das Poster aufrufen (Nummer? Autor? Bereich?) und man kann nur in Abschnitten sehen (viele Clicks!). Die Zeiten, in denen man durch die Poster schlenderte, einen Überblick über die Aktivitäten der Arbeitsgruppen und Themen bekam und mit Kollegen spontan diskutierte, sind wohl vorbei. Aber vielleicht gibt es hier ja auch mal einen (wünschenswerten) Rückschritt, denn die Posterdiskussionen waren ausgesprochen schlecht besucht.

Die
Auswertung der Daten der Zirrhotiker, die im Rahmen von Compassionate
Use Programmen behandelt wurden,
bestätigen
die gute Effektivität und ausgezeichnete Verträglichkeit der DAA im
klinischen Alltag. Erstmals lassen sich hier auch SVR-Raten
verschiedener Regime vergleichen. Mit Rückschlüssen auf eine
unterschiedliche Wirksamkeit sollte man jedoch sehr vorsichtig sein,
denn ein „Channeling Bias“ ist aufgrund der freien Auswahl des
Regimes durchaus möglich. In der amerikanischen Kohorte HCV-TARGET
(n= 217, MELD >10) schnitt Sofosbuvir + Ribavirin im Vergleich zu
Sofosbuvir + Simeprevir oder Sofosbuvir + Simeprevir + Ribavirin
deutlich schlechter ab. Bei GT1 lagen die SVR12-Raten bei 74% bzw.
66% bzw. 52%. Bei Genotyp 3 heilte Sofosbuvir + Ribavirin nur 39% der
Patienten (Reddy KR et al., #O005). Ein negativer Prädiktor für die
Heilung war die Zirrhose, insbesondere im Zusammenhang mit einer
schlechten Nierenfunktion. Die Niereninsuffizienz per se scheint
allerdings kein Prädiktor für schlechteres Ansprechen zu sein. Sie
erhöht jedoch die Gefahr von Nebenwirkungen unter Sofosbuvir. Die
Analyse der Daten zeigte mit dem Abfall der eGFR (>60 bis <30)
einen Anstieg von renalen Nebenwirkungen (akutes Nierenversagen,
Verschlechterung der Nierenfunktion, Dysurie usw.) (Saxena V et al.,
#LP08).
In Europa war neben Sofosbuvir und Simeprevir auch der NS5A-Inhibitor Daclatasvir zum Compassionate Use verfügbar. In England wurden Patienten mit dekompensierter Zirrhose 12 Wochen lang mit Sofosbuvir + Ledipasvir oder + Daclatasvir ± Ribavirin behandelt. Die SVR-Raten lagen insgesamt bei über 70% (Foster G et al, #O002). In einer französischen Analyse der Daten von 601 Patienten mit GT3 (76% Zirrhose, 73% vorbehandelt) erreichten durch Sofos-buvir+Daclatasvir 92% der Patienten ohne Zirrhose und 88% der Zirrhotiker die SVR (Hezode C et al., #LP05).
OPTIMIST: Simeprevir + Sofosbuvir
Simeprevir sowie Daclatasvir ohne Interferon wurden in Europa aufgrund von Phase-2-Studien zugelassen. Nun liefern die Unternehmen die Phase-3-Daten nach. In den OPTIMIST-Studien wurde Simeprevir, in den ALLY-Studien Daclatasvir geprüft – jeweils in Kombination mit Sofosbuvir.
In
OPTIMIST-1 erhielten Patienten ohne Zirrhose 8 oder 12 Wochen
Simeprevir + Sofosbuvir, in OPTIMIST-2 mit Zirrhose 12 Wochen lang.
Die Verkürzung der Therapiedauer auf 8 Wochen in OPTIMIST-1 war nur
bei GT1b ohne Wirkverlust (92% vs. 97%) oder bei einer
Ausgangsviruslast <4 Millionen IU/ml möglich. In allen anderen
Fällen schnitten
12 Wochen
besser ab. Hier lagen die SVR-Raten in allen Subgruppen, und zwar
auch bei den Patienten mit GT1a und Q80K bei >95% (Kwo P et al.,
#LP14). Bei den Zirrhotikern in OPTIMIST-2 spielte die Q80K dagegen
sehr wohl eine Rolle. Die SVR betrug bei den Therapie-naiven
Patienten 88%, bei den vorbehandelten 79% und bei den Patienten mit
GT1a ohne Q80K 92%, jedoch mit Q80K nur 74% (Abb. 4). Negative
Prädiktoren waren zudem Thrombozyten <90.000/µl (68%) und ein
Albumin <4 g/dl (74%) (Abb. 4) (Lawitz E et al., #LP04).
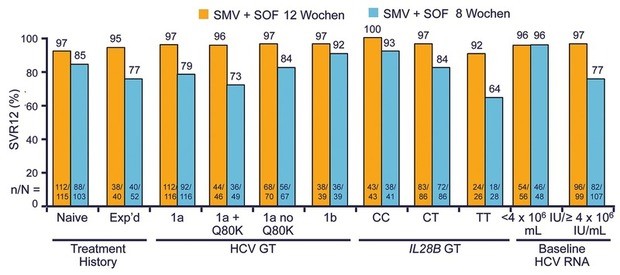
Abb. 4 OPTIMIST-1: Simeprevir + Sofosbuvir bei GT1 ohne Zirrhose. SVR12 (%). Kwo P et al. EASL 2015. Abstract LP14
MALACHIT: Triple vs 3D
Ebenfalls eine Premiere war die Präsentation des ersten direkten Vergleichs einer Interferon-basierten Tripletherapie mit einem Interferon-freien Regime. Im Rahmen der Studien MALACHIT-1 und -2 erhielten therapienaive bzw. dual vorbehandelte Patienten mit GT1 ohne Zirrhose entweder 12 Wochen das 3D-Regime oder eine Telaprevir-basierte Tripletherapie. Erwartungsgemäß war die Therapie ohne Interferon besser wirksam und besser verträglich. Die SVR-Raten waren nach 3D bei Therapie-naiven mit GT1a um 15% höher, mit GT1b um 20% und bei vorbehandelten Nullrepondern um mehr als 30%. Nebenwirkungen waren ohne Interferon seltener (62% vs. 91%) und die Lebensqualität unter Therapie besser (Dore GJ et al., #PO847; Conway B et al., #PO842).
Die Studien MALACHIT-1 und -2 belegen somit, was man eigentlich schon vorher wusste. Aber nun gibt es endlich schwarz auf weiß, was das deutsche IQWIG fordert. Dass für die deutsche Arzneimittel-Politik Patienten im Ausland Nebenwirkungen in Kauf nehmen mussten, steht auf einem anderen Blatt. Es bleibt nur zu hoffen, dass damit dieses Kapitel geschlossen ist und der Vergleich auch für andere DAA-Regime gilt.
Bei GT1B ohne Dasabuvir?
Der GT1b ist am empfindlichsten auf die DAA. Bei Sofosbuvir + Simeprevir kann man laut OPTIMIST-1 auch 8 Therapie verkürzen oder – so die Studie GIFT-1 – bei 12 Wochen Therapiedauer auf den nicht-nuklerosidischen Polymerasehemmer Dasabuvir verzichten. Von den 363 Patienten mit GT1b erreichten 90% der Zirrhotiker und über 95% der Therapie-naiven sowie Vorbehandelten mit GT1b nach 12 Wochen allein mit Paritaprevir/Ritonavir/Ombitasvir die SVR (Chayama K et al., #G13).
Sofosbuvir-Triple bei GT3
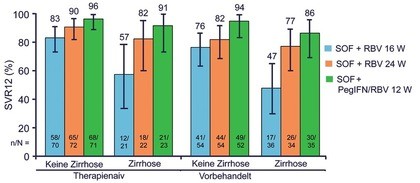
Abb. 5 pPegIFN – Ribavirin 12 Wochen vs Sofosbuvir + Ribavirin 16 oder 24 Wochen bei GT2/3. SVR-Raten (%)
Am schwierigsten zu behandeln ist derzeit der Genotyp 3, insbesondere die Patienten mit Zirrhose. In der TARGET-Kohorte betrug die SVR-Rate der vorbehandelten GT3-Zirrhotiker nach Sofosbuvir/Ribavirin lediglich 44% (Alqahtani S et al., #PO840). Im englischen Compassionate Use war die SVR bei GT3 und Zirrhose nach Sofosbuvir/Ledipasvir mit 43% (plus Ribavirin 59%) ebenfalls niedrig, nach Sofosbuvir/Daclatasvir mit 71% (plus Ribavirin 70%) (Foster G et al., #O002) deutlich besser. Dieses schlechte Ergebnis lässt sich möglicherweise durch eine Verlängerung der Therapie oder durch Interferon verbessern. Im französischen Compassionate Use Programm steigerte die Verlängerung der Behandlung (Sofosbuvir/Daclatasvir) von 12 auf 24 Wochen um 12% (76% vs. 88%) (Hezode C et al., #LP05). In der BOSON-Studie zeigte Interferon keinen additiven Nutzen bei Zirrhotikern mit GT2, wohl aber bei Patienten mit GT3 (naiv/vorbehandelt, mit/ohne Zirrhose). Hier wurden nur mit der Sofosbuvir-basierten Tripletherapie SVR-Raten >90% erreicht. Therapieabbrüche waren unter Interferon nicht häufiger, lediglich die Raten von Anämien und Thrombozytopenien waren deutlich höher (Abb. 5) (Foster G et al., #LO5).
Genotyp 4 und 5
Sofosbuvir/Ledipasvir kann als pangenotypisches Regime auch bei den selteneren Genotypen 4 und 5 gegeben werden. 12 Wochen führten bei naiven wie vorbehandelten Patienten mit oder ohne Zirrhose zu SVR-Raten über 90%. Es scheint jedoch Unterschiede bei den GT4-Subtypen Unterschiede zu geben. Zwei Drittel der Patienten mit Subtyp 4r hatten einen Relaps (Abergel A et al., #O056).
Später Relaps?
Wenn bei Patienten später als 12 Wochen nach erfolgreicher Behandlung der Hepatitis C erneut HCV nachgewiesen wird, handelt es sich dann um einen späten Relaps oder eine Neuinfektion? Dieser Frage ging Christoph Sarrazin, Frankfurt nach und verglich die Gensequenz der Viren vor und nach Therapie bei 12 Patienten, die zwischen Woche 12 und 24 nach einer erfolgreichen Behandlung erneut HCV-RNA-positiv wurden. Bei 5/12 Patienten handelte es sich um einen späten Relaps. 7 Patienten hatten sich neu angesteckt. Die gute Nachricht: Die Konkordanz der SVR12 und SVR24 liegt bei 99,7% (Sarrazin C et al., #O063).
Re-Therapie
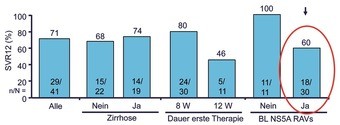
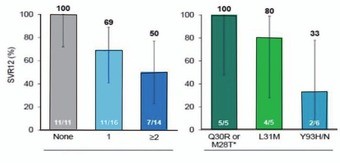
Abb. 6a und b 24 Wochen Re-Therapie mit Sofosbuvir/Ledipasvir nach Versagen von 12/8 Wochen Sofosbuvir/Ledipasvir bei GT1. a) SVR12-Raten (%) nach Zirrhose-Status, Dauer der ersten Therapie und Baseline-RAVs, b) SVR-Raten (%) nach Zahl und Art der RAVs, Lawitz E et al. EASL 2015. Abstract O005
Was tun nach Versagen einer Interferon-freien Behandlung? Die Option, einfach noch mal, aber länger behandeln, wurde nach Versagen von Sofosbuvir/Ledipasvir geprüft. 41 Versager wurden 24 Wochen lang erneut mit Sofosbuvir/Ledipasvir behandelt. Insgesamt konnten 71% der Patienten durch die längere Re-Therapie geheilt werden. Negative Prädiktoren waren vorbestehende RAVs (Resistenz-assoziierte Varianten). Die Häufigkeit der RAVs zu Baseline stieg mit der Dauer der Ersttherapie. So hatten 63% der initial 8 Wochen behandelten Patienten NS5A-RAVs im Vergleich zu 100% der 12 Wochen Behandelten. Die NS5A-Mutationen hatten entscheidenden Einfluss auf den Therapieerfolg. Alle Patienten ohne RAVs wurden durch die zweite Therapie geheilt, aber nur 60% derjenigen mit NS5A-RAVs. Zudem spielten Anzahl und Art der RAVs eine Rolle. Am ungünstigsten waren mehr als 2 RAVs sowie die Mutation Y93H/N mit einer SVR bei 2/6 Patienten (Abb. 6a und b). NS5B-RAV gab es vor der Re-Therapie nicht. Am Ende der zweiten Behandlung hatten dann 4/12 Patienten mit virologischem Versagen eine entsprechende Variante (2x S282T, 1x L159F, 1x S282T + L159F) (Lawitz E et al., #O005).
Einfach abzuwarten, bis die Mutationen verschwinden, ist nicht in jedem Fall eine Option. Das kann bei NS3/4A- und (Non-Nuke)NS5B-RAVs funktionieren. Diese Mutationen waren in einer Nachbeobachtung nach 48 Wochen schon fast verschwunden. NS5A-RAVs können jedoch deutlich länger, nämlich >96 Wochen nach Therapieende persistieren.
Grazoprevir/Elbasvir
Zahlreiche neue Substanzen und Regime sind in der Entwicklung. Besonders weit fortgeschritten ist die Fixkombination Grazoprevir/Elbasvir von MSD. Das pangenotypische Regime wird in den „C-Studien“ bei verschiedenen Patientenpopulationen geprüft. In Wien wurden neben C-SURFER (Niereninsuffizienz, siehe oben), C-EDGE (naiv und vorbehandelt, GT 1, 4 und 6, HIV-Koinfektion), C-SCAPE (GT 2, 4, 5 und 6 ohne Zirrhose), C-WORTHY (GT1b ohne Zirrhose), C-SALVAGE (nach DAA-Versagen) und C-SWIFT (Therapieverkürzung) präsentiert.
Die
SVR-Rate in C-EGDE TN nach 12 Wochen Grazoprevir/Elbasvir lag bei 95%
(99% GT1b und 92% GT1a, Zirrhose 97%). Virologisches Versagen bei den
GT1a-Patienten (n=10/157) korrelierte mit Baseline-RAVs mit einer
mehr als 5fachen-Resistenz (Zeuzem S et al., #G07). Bei den dual
vorbehandelten Patienten in C-EGDE TE scheinen 12 Wochen Therapie
ebenfalls auszureichen (SVR12 94%) (Kwo P et al., #P0886.).
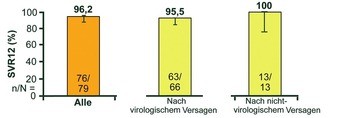
Abb. 7 C-SALVAGE: Grazopevir/Elbasvir nach DAA-Versagen. SVR12 (%), Forms X et al., #O001
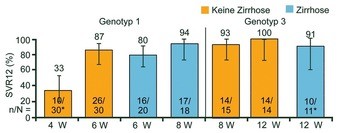
Abb. 8 C-SWIFT: Grazoprevir/Elbasvir + Sofosbuvir. SVR12 (%). Poordad F et al., #O006
Patienten nach einer DAA-basierten Trip-letherapie (Boceprevir, Simeprevir oder Telaprevir) wurden im Rahmen von C-SALVAGE (n=79) 12 Wochen lang mit Grazoprevir/Elbasvir plus Ribavirin behan-delt. 80% (66/79) der Patienten hatten viro-logisch versagt, bei den übrigen Patienten war die Behandlung aus anderen Gründen nach vier Wochen abgebrochen worden. 34/79 Patienten hatten NS3-RAVs. Die SVR12 Rate lag bei insgesamt 96% und zwar 100% bei Patienten ohne virologisches Versagen und bei 95,5% bei Patienten mit vorherigem virologischen Versagen (Abb. 7). Die drei Relapser hatten zu Baseline und nach der Retherapie neue NS3- und NS5A-RAVs (Forns X et al., #O001).
Therapieverkürzung
Die Latte für neue Regime hängt hoch, deshalb sucht man nach Möglichkeiten, die Therapie zu verkürzen. In C-SWIFT waren 4 und 6 Wochen Grazoprevir/Elbasvir zu kurz (SVR12 33% und 80%), während 8 Wochen selbst 94% der Zirrhotiker und 93% der Patienten mit GT3 heilte (Abb. 8) (Poordad F et al., #O006).
Selbst bei der 3er-Kombination Sofosbuvir/GS-5816 (NS5B/NS5A-Inhibitor) plus GS-9857 (NS3/4A-Inhibitor) waren 4 Wochen Behandlung bei GT1 nicht ausreichend (SVR12 27%). 6 Wochen Therapie heilten dagegen 93% der Therapienaiven ohne Zirrhose und 87% derer mit Zirrhose. Die SVR12 bei früherem DAA-Versagen und Zirrhose lag dagegen nur bei 67% (Gane EJ et al., #LP03).
News im Überblick
- Die neuen Therapien halten im Alltag, was sie in Studien versprechen.
- Auch Patienten mit dekompensierter Zirrhose können behandelt und geheilt werden.
- Therapie der Re-Infektion nach Lebertransplantation möglich und erfolgreich.
- „Schwierig zu behandelnde“ Patienten scheinen von einer längeren Therapie und der zusätzlichen Gabe von Ribavirin zu profitieren.
- Niereninsuffizienz: 3D-Regime gut verträglich, Ribavirin allerdings problematisch. Die Kombination Grazoprevir/Elbasvir ohne Ribavirin gut wirksam und verträglich. Sofosbuvir (Kontraindikation GFR <30 ml/Min!) ebenfalls wirksam, aber mehr renale Nebenwirkungen.
- Bei erneut positiver HCV-RNA zwischen Woche 12 und 24 nach Therapieende ist eine Neuinfektion wahrscheinlicher als später Relaps (60% vs. 40%).
- Beim virologischen Versagen von DAA entstehen meist Resistenz-assoziierte Varianten. NS5A-RAVs persistieren über Jahre und beeinträchtigen den Erfolg einer Re-Therapie.
- Bei Simeprevir/Sofosbuvir spielt die Variante Q80K nur bei zusätzlichen negativen Prädiktoren wie Vorbehandlung plus Zirrhose eine Rolle. Therapieverkürzung auf 8 Wochen könnte bei GT1b und einer Viruslast <4 Millionen IU/ml möglich sein (Off Label!)
- Bei GT1b kann selbst bei Patienten mit Zirrhose 12 Wochen Paritaprevir/Ritonavir/Ombitasvir ohne Dasabuvir gegeben werden (Off Label!).
- Bei GT3 ist 12 Wochen Sofosbuvir-basierte Tripletherapie aussichtsreicher als Sofosbuvir + Ribavirin über 24 Wochen.
Hepatitis B
Auch zur Hepatitis B gab es Neuigkeiten. Unter den neuen Substanzen gegen Hepatitis B ist der Polymerasehemmer REP 2139-Ca, der sowohl gegen HBV als auch HDV aktiv ist. Gleichzeitig verminderte die Substanz in früheren Studien die cccDNA von HBV in der Leber (Bazinet M et al., #LO2). Vorgestellt wurde auch ein „HBV Core Inhibitor“ NVR 3-778, der in vitro mit Polymerasehemmern oder anderen Core-Modulatoren additive Effekte zeigt (Klumpp K et al., #O115).
Zur alten Frage, ob und wann man eine komplett suppressive Hepatitis B Therapie mit Polymerasehemmern absetzen kann, gab es interessante Daten aus Leipzig. Im Rahmen der „FINITE CHB“ wurde bei 21 /42 Patienten mit einer HB-Viruslast <400 Kopien/ml für mindestens 3,5 Jahre Tenofovir abgesetzt, während 21/42 Patienten mit Tenofovir weiter behandelt wurden. Alle Patienten waren HbsAg-positiv und HBeAG-negativ und alle hatten eine normale GPT. Kein Patient hatte eine Zirrhose.
Präsentiert wurden die 48-Wochen-Daten. Bei allen Patienten stieg die HB-Viruslast innerhalb von 12 Wochen nach dem Absetzen der Behandlung an. 3 Patienten (14%) mussten wieder mit der Therapie beginnen (2 Flares, 1 anhaltende hohe Virämie). Auch bei den übrigen Patienten stieg die GPT an, jedoch meist nicht über 2xULN. 83% der Patienten hatten nach 48 Wochen sogar eine normale GPT. Die Viruslast lag meist <20.000 IU/ml, bei 78% <2.000 IU/ml. Zwei Patienten verloren HbsAg (Berg T et al., #O119).
Nicht-alkoholische Steatohepatitis (NASH)
Die NASH wird 2020 die häufigste Form der Lebererkrankungen darstellen. Ursache ist eine Verfettung des Lebergewebes, was zu entzündlichen Reaktionen und zur Leberzirrhose führen kann. Dennoch sind nur wenige Patienten mit NASH in der Lage, den Fettgehalt der Leber durch Änderung des Lebensstils und/oder Diät zu reduzieren. Auf dem Kongress wurden zwei medikamentöse Ansatze aufgezeigt. In einer Phase-2-Studie verschwand die NASH bei einem Drittel der Patienten nach einem Jahr Behandlung mit dem Inkretinmimetikum Liraglutid (Victoza®) (Armstrong M et al., G01). In einer zweiten Untersuchung erhielten unbehandelte Diabetiker 12 Wochen lang Remoglifozin Etabonat, einen Natrium-abhängigen Glukose-Kotransporter. Es kam zur Verbesserung der Insulinsensitivität sowie zum Abfall der GPT (Wilkinson W et al., #O046). In beiden Studien nahmen die Patienten ab und es stellt sich die Frage, ob diese Substanzen auch einen vom Gewichtsverlust unabhängigen Wirkmechanismus haben.
Neue EASL-Leitlinien
Gleich zu Beginn des Kongresses erschienen die neuen Leitlinien der EASL. Die europäischen Leitlinien unterscheiden sich von den kürzlich publizierten deutschen Leitlinien. So empfiehlt die EASL eine Priorisierung der Behandlung nach Schweregrad der Leberschädigung. „Jeder hat das Recht, behandelt zu werden, aber wir sehen die Realität. Die Medikamente sind zu teuer, um die große Zahl der Betroffenen in den nächsten Jahren behandeln zu können. Deshalb müssen wir priorisieren“, erklärte Jean-Michel Pawlotsky, Lyon. Des Weiteren werden Interferon-haltige Regime noch empfohlen – allerdings nur im Rahmen der Tripletherapie mit Sofosbuvir oder Simeprevir. Die duale Therapie bzw. die Tripletherapie mit Boceprevir oder Telaprevir wird nur noch für Länder ohne andere Optionen empfohlen. Neu sind auch die klaren Empfehlung zur Retherapie bei Versagen einer DAA-haltigen Vorbehandlung sowie übersichtliche Tabellen zu Interaktionen.
| Therapie | Patientengruppe |
|---|---|
| ... sollte priorisiert werden | Signifikante Fibrose (F3) oder Zirrhose (F4) Inklusive dekompensierte Zirrhose HIV-Koinfektion HBV-Koinfektion Indikation zur Lebertransplantation HCV-Rezidiv nach Lebertransplantation Klinisch signifikante extrahepatische Manifestationen Einschränkende Müdigkeit Risiko der Transmission |
| ... ist gerechtfertigt | Moderate Fibrose (F2) |
| ... kann später erfolgen | Keine oder milde Leberfibrose (F0-1) und keine der erwähnten extrahepatischen Manifestationen |
| ... wird nicht empfohlen | Limitierte Lebenserwartung wegen nicht-hepatischer Erkrankung |










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
