Ulrich Seybold, München
Latente Tuberkulose-Infektion und Immunschwäche
Steigende Meldezahlen
Auch wenn die Tuberkulose (TB) in Deutschland seit langem eine seltene Erkrankung ist, zeigen seit 2013 die Meldedaten des Robert Koch-Instituts wieder einen zunehmenden Trend. In Deutschland erkrankten 2014 4.488 Personen an TB, damit lag die Inzidenz bundesweit bei 5,6 Fällen/100.000.1 Hauptgrund für den Anstieg der Meldezahlen ist der Zuzug von Patienten aus Hochinzidenzländern. Dies bedingt einen steigenden Anteil von im Ausland geborenen Patienten mit TB: 2013 betrug er 50%, 2015 bereits etwa 2/3. Auch die Verteilung dieser Herkunftsländer hat sich verändert. Stammte bis 2013 ein Großteil der TB-Patienten aus den Nachfolgestaaten der Sowjetunion (NUS) und der Türkei, so ist 2014 mit Somalia erstmals ein afrikanisches Land am häufigsten als Geburtsland angegeben.1 Ab 2015 spielen Afrika und auch der Nahe Osten eine nochmals größere Rolle.2
Mehr latente Infektionen
Die Exposition gegenüber M. tuberculosis führt bei Immungesunden üblicherweise nicht zu einer klinisch manifesten Erkrankung, da durch Granulombildung eine schnelle Immunkontrolle der Tuberkelbakterien erreicht wird. Dieser Zustand definiert die latente Infektion mit M. tuberculosis (LTBI), von der weltweit etwa 2 Milliarden Menschen betroffen sind.3 Die verstärkte Zuwanderung aus Hochinzidenzländern führt jetzt in Deutschland auch zu einer Zunahme von Fällen mit LTBI. Aktuell werden bei Geflüchteten im Rahmen des Screening-Untersuchungen nach §62 AsylG/§36 Abs. 4 IfSG entweder durch auffällige Befunde der Röntgen-Thoraxaufnahme („Pleurakuppenschwielen“) oder durch die bei jungen Patienten oder Schwangeren durchgeführten Interferon-gamma-Release-Assays (IGRA) bereits eine Reihe von LTBI-Fällen diagnostiziert. Zusätzlich bedingt die Zunahme aktiver TB-Infektionen auch in Deutschland eine erhöhte Anzahl exponierter Personen und damit von LTBI-Fällen.
Indikation zur Diagnostik
Selbst viele Jahre inaktive Tuberkelbakterien können durch Verlust der Immunkontrolle im Granulom erneut replizieren und wieder einen klinisch manifesten Organbefall verursachen. Allerdings kommt es nur bei einem kleinen Teil der Menschen mit LTBI zu einer Reaktivierung. Eine präventive Therapie (oder „Chemoprävention“, in Abgrenzung zur „Chemoprophylaxe“ zur Verhinderung einer Erstinfektion) sollte daher nur Personen mit LTBI angeboten werden, die ein erhöhtes Risiko für eine Reaktivierung haben. Und nur bei diesen Personen sollte daher überhaupt eine entsprechende Diagnostik durchgeführt werden. Allerdings wird in Deutschland dem Prinzip „intention to test is intention to treat“ oft nicht gefolgt.4
Generell sollten Personen mit dokumentierter (rezenter) TB-Exposition untersucht werden, da das Risiko für eine Reaktivierung in den ersten 2 Jahren nach Primärinfektion am höchsten ist. Außerdem sind insbesondere Situationen mit systemischer Immundefizienz wie die (v.a. unbehandelte5) HIV-Infektion, eine dialysepflichtige Niereninsuffizienz, der Einsatz von TNF-α-Inhibitoren oder die Immunsuppression nach Knochenmarks- oder Organtransplantation mit einem erhöhten Aktivierungsrisiko assoziiert.6-8 Auch die Silikose mit ca. 1.000 Fällen/Jahr9 ist ein Risikofaktor. Weitere akzeptierte Risikofaktoren sind Situationen mit weniger eindeutigem pathophysiologischen, aber gesichertem epidemiologischen Zusammenhang zur Reaktivierung einer LTBI. Für sehr häufige Situationen mit möglicherweise ebenfalls erhöhtem TB-Reaktivierungsrisiko wie etwa Diabetes mellitus, Rauchen oder die Gabe von Immunsuppressiva inklusive Glucocorticoide außerhalb des Transplantationssettings ist derzeit von der WHO keine spezifische LTBI-Diagnostik empfohlen.8 Tabelle 1 gibt einen Überblick über die beschriebenen Risikofaktoren und die Empfehlungen der WHO und des DZK bzgl. der Indikation für eine Testung bzw. eine präventive Therapie.
Risikofaktoren für Reaktivierung
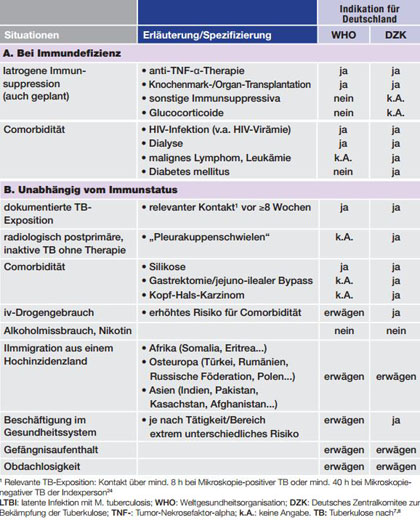
Tab. 1 Indikationen für LTBI-Testung bzw. präventive Therapie
Bei Patienten in Deutschland nimmt seit Jahren die Prävalenz von Risikofaktoren für die Aktivierung einer bestehenden LTBI zu. Den stärksten Effekt hat hierbei die demographische Entwicklung mit der aus dem höheren erreichten Lebensalter resultierenden Zunahme von malignen Erkrankungen. Auch die Zahl HIV-infizierter Personen nimmt in Deutschland zu10, außerdem benötigen immer mehr Patienten Nierenersatzverfahren.11 Auch Fälle mit iatrogener Immunsuppression werden häufiger: an erster Stelle hier steht der Verbrauch an TNF-α-Inhibitoren in der Rheumatologie, der in Deutschland stetig steigt.12 Bzgl. der absoluten Zahlen zwar weniger relevant aber im Einzelfall dafür bzgl. Dokumentation und Konsequenz für die Therapieplanung besonders wichtig sind Knochenmarkstransplantationen mit ebenfalls steigender Tendenz auf ca. 3.200 im Jahr 201413 und solide Organtransplantationen, die allerdings zuletzt mit 200-300 Fällen/Jahr eher rückläufig waren.13
Neben einer Zunahme von LTBI-Fällen werden also in Deutschland auch die Situationen häufiger, in denen eine entsprechende Testung empfohlen wird (Tab. 1). Für diese Diagnostik kommt nach Anamnese und körperlicher Untersuchung zum Ausschluss einer möglichen aktiven TB entweder der Tuberkulin-Hauttest (THT) oder ein Interferon-γ-Release-Assay (IGRA) zum Einsatz.
iGRA
In den letzten Jahren hat der Einsatz der bereits in den 1990er Jahren entwickelten IGRAs dramatisch zugenommen. Sie ermöglichen den Nachweis einer TB-spezifischen Immunreaktion anhand der gesteigerten Produktion von Interferon-γ nach Stimulation mit TB-Antigenen. In Deutschland sind aktuell zwei IGRA verfügbar, ein möglicherweise bzgl. der Präanalytik etwas unproblematischerer ELISA-basierter Test sowie ein eventuell in manchen Situationen etwas sensitiveres Elispot-Verfahren. Allerdings sind beide gerade bei Patienten mit Immunsuppression oder Immundysregulation häufiger nicht eindeutig interpretierbar: nicht selten zeigen sich bei diesen Patienten „unbestimmte“ Ergebnisse. Ein Grund hierfür kann beim ELISA eine negative Auslesung der Positivkontrolle sein, die außer bei ausgeprägter Immundefizienz auch durch Über- oder Unterfüllung des Röhrchens oder zu lange Lagerung der Probe auftreten kann. Bei beiden Testverfahren können i.R. einer „Immunaktivierung“ z.B. bei HIV-Infektion hohe Werte der Negativkontrolle bzw. des Null-Panels zu ebenfalls nicht interpretierbaren Ergebnissen führen. Falsch-negative Tests müssen v.a. bei ausgeprägter Immundefizienz in Betracht gezogen werden, außerdem gibt es Hinweise auf nicht seltene falsch-positive Ergebnisse v.a. in Niedrigrisiko-Populationen bzgl. TB-Exposition.14 Auch wenn beide IGRA prinzipiell quantitative Verfahren sind, ist die Auswertung lediglich qualitativ, für die Abschätzung des Risikos der Aktivierung einer LTBI sind sie ebenso wenig geeignet wie zur Verlaufs- oder Abschlusskontrolle einer (präventiven) Therapie.
Tuberkulin-Hauttest
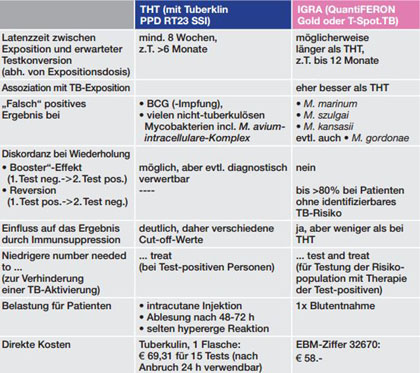
Tab. 2 Vergleich Tuberkulin-Hauttest (THT) vs. Interferon-gamma-Release-Assay (IGRA) nach14,15,25-27
Seit Verfügbarkeit der IGRA ist der Einsatz des THT deutlich zurückgegangen. Dies liegt an der schlechteren Spezifität des THT, der auch nach BCG-Impfung und häufiger nach Exposition gegenüber nichttuberkulösen Mykobakterien (NTM) ein positives Ergebnis zeigen kann, sowie der Notwendigkeit der Wiedervorstellung 48-72 h nach Anlage zur Ablesung. Allerdings hat der THT gegenüber den IGRA auch Vorteile. Neben den im Rahmen der gleichzeitigen Testung mehrerer Patienten niedrigeren direkten Kosten ist hier v.a. der besser untersuchte prädiktive Wert bzgl. der Reaktivierung einer LTBI, die möglicherweise kürzere Zeit zwischen Exposition und Konversion15 und die niedrigere Anzahl der zu behandelnden Personen, um eine TB-Reaktivierung zu verhindern5 zu nennen. Für die Testauswahl relevante Charakteristika des THT und der IGRA sind in Tabelle 2 gegenübergestellt.
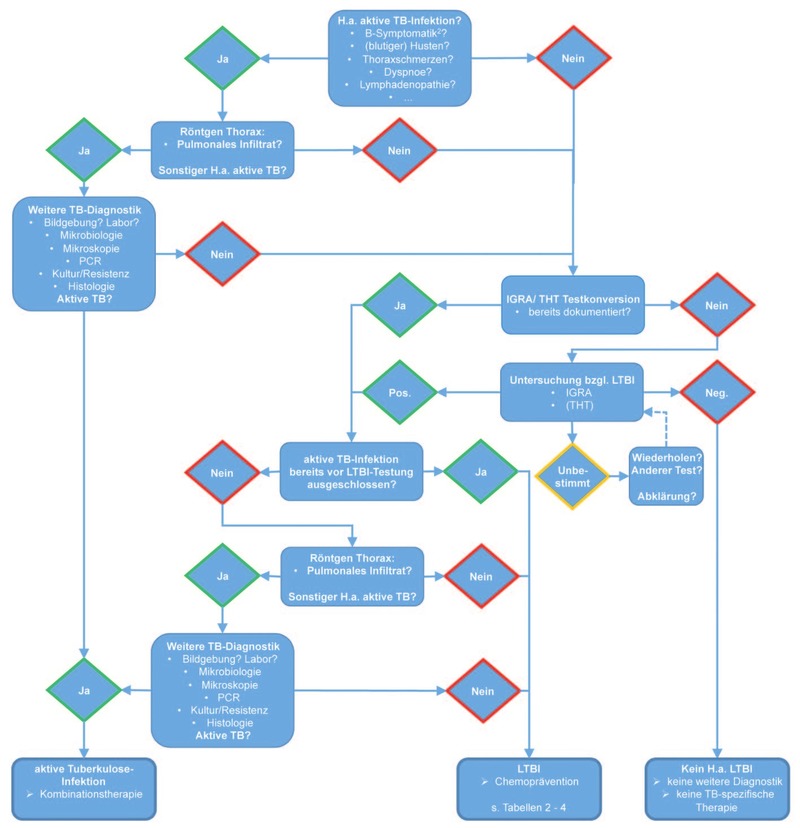
In einer Niedrigprävalenzsituation wie in Deutschland hat ein negatives THT- oder IGRA-Ergebnis einen hohen negativen prädiktiven Wert für eine TB-Reaktivierung von >97%.16 Sowohl IGRA als auch der THT können nicht zwischen latenter und aktiver TB-Infektion unterscheiden, daher muss bei positivem Testergebnis eine aktive TB ausgeschlossen werden. Dies geschieht primär durch eine Röntgenaufnahme des Thorax zum Ausschluss von Infiltraten und mediastinaler Lymphadenopathie. Wenn sich kein Hinweis auf eine aktive TB ergibt, besteht für die LTBI auch keine Meldepflicht.1 Das nach den aktuellen Leitlinien7,8 empfohlene Vorgehen zur LTBI-Abklärung bei Patienten mit entsprechender Indikation (Tab. 1) ist in der Abbildung 1 dargestellt.
Auswahl der Therapie
Eine Therapieindikation bei LTBI zur Senkung des persönlichen Risikos17 für eine TB-Aktivierung ergibt sich bereits aus der Indikation zur Testung. Dieser Risikoreduktion muss aber immer die Belastung durch und mögliche Toxizität der Therapie gegenübergestellt werden. Die breiteste Evidenzbasis besteht für eine Isoniazid (INH)-Monotherapie über 6 oder 9 Monate. Im Rahmen einer direkt beobachteten Therapie (DOT) bietet die 1x wöchentliche Einnahme von INH und Rifapentin (RFP) den Vorteil einer mit 12 Wochen kürzeren Therapiedauer mit weniger Tabletten und geringeren Nebenwirkungen, insbesondere weniger Hepatotoxizität. RFP ist allerdings in Deutschland nur als Import erhältlich und in den USA nicht für Schwangere oder Patienten mit HIV-Infektion empfohlen.18 Eine weitere Alternative zu INH z.B. bei (vermuteter) Resistenz oder Unverträglichkeit ist der Einsatz von Rifampicin (RMP) als (in Deutschland nicht zugelassene) Monotherapie über (3-)4 Monate. Zur besseren Kontrolle des ausgeprägten Wechselwirkungspotentials von RMP z.B. bei gleichzeitiger HIV-Therapie kann auch Rifabutin (RFB, hierfür ebenfalls nicht als Monotherapie zugelassen) verwendet werden. Die Kombination von INH und RMP über (3-)4 Monate scheint nicht toxischer, aber wohl auch nicht wirksamer zu sein als die entsprechenden Monotherapien. Klar kontraindiziert ist inzwischen die Kombination von RMP mit Pyrazinamid (PZA) aufgrund der signifikant erhöhten Mortalität7,8, die Aufrechterhaltung der Empfehlung für die Kombination RFB und PZA als Alternative bei HIV-Infektion in den DZK-Leitlinien7 scheint daher problematisch. Die Verwendung anderer nicht-INH/Rifamycin-Kombinationen zur Behandlung einer LTBI in ausgewählten Spezialfällen sollte Experten vorbehalten bleiben. Einen Überblick über die bei der LTBI-Therapie eingesetzten Medikamente gibt Tabelle 3, die möglichen von den entsprechenden Leitlinien empfohlenen Regimes sind in Tabelle 4 dargestellt.
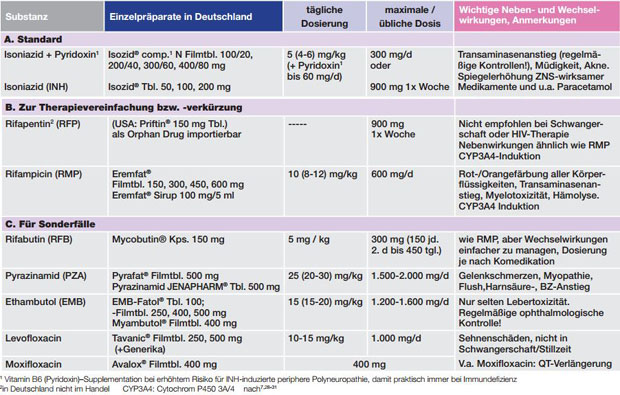
Tab. 3 Medikamente zur Behandlung der Latenten Infektion mit M. tuberculosis (LTBI)
Offene Fragen
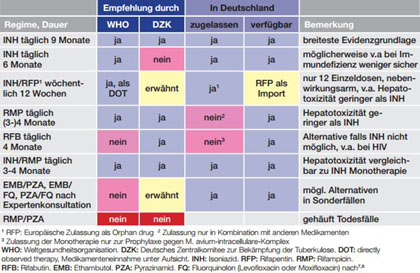
Tab. 4 Mögliche Regimes zur Therapie einer latenten Infektion mit M. tuberculosis (LTBI)
Während bei HIV-infizierten Patienten etwas ältere Schweizer Daten noch einen klaren protektiven Effekt einer präventiven Therapie nach positivem THT zeigen17, legt eine neuere europaweite Studie nahe, Test- und Behandlungsbemühungen auf Patienten mit unkontrollierter HIV-Infektion zu fokussieren, da die Reaktivierung einer LTBI bei virologisch suffizient behandelten Patienten wahrscheinlich ein extrem seltenes Ereignis ist.19 Ob auch für andere Ursachen von Immundefizienz bestimmte Patienten (sub)gruppen mit besonders hohem Risiko identifizierbar sind, ist noch weniger klar.
Eine allgemeingültige Empfehlung für das im individuellen Fall optimale Testverfahren erscheint derzeit v.a. aufgrund der in den Studien z.T. sehr unterschiedlichen Patientengruppen kaum möglich. Gerade bei Patienten mit Immundefizienz sind bei allen Testverfahren falsch-negative oder nicht eindeutige Testergebnisse möglich. Andererseits ermöglicht keiner der Tests bei positivem Ergebnis eine gute Prädiktion bzgl. der (für Patienten in Europa wohl eher seltenen20,21) späteren Progression zu einer manifesten TB-Erkrankung. Trotz mancher unbestrittener Vorteile des THT (kürzere Latenzzeit, weniger falsch-positive Ergebnisse15) hat sich in Deutschland aber inzwischen wohl v.a. aufgrund der einfacheren Handhabung die Benutzung von IGRAs zur LTBI-Diagnostik durchgesetzt.
Hohes Ziel
Für die LTBI-Therapie besteht neben dem Patienten-orientierten Ziel der Krankheitsvermeidung weiterhin auch das von der WHO ausgegebene epidemiologische Ziel der (Prä-) Elimination der TB im Rahmen der End-TB-Strategie.22 In Anbetracht der aktuellen Entwicklung erscheint dies aber zumindest für Deutschland aktuell unrealistisch23, die dadurch bedingte größere Zahl von Testungen und ggfs. Behandlungen wird daher auch entsprechend kritisch diskutiert. Neben der Frage, wer eine Chemoprävention erhalten sollte, ist schließlich noch die Frage nach dem jeweils optimalen Regime und der optimalen Behandlungsdauer nicht abschließend geklärt. Der breiten Evidenzbasis der INH-Monotherapie stehen hier unbestreitbare Vorteile alternativer Regimes gegenüber, wie etwa eine kürzere Therapiedauer und/oder niedrigere Toxizität. Zusätzlich wird die Auswahl noch durch den aktuellen Stand der Zulassung und Verfügbarkeit einzelner Medikamente in Deutschland kompliziert.
1 Robert Koch-Institut. Bericht zur Epidemiologie der Tuberkulose in Deutschland für 2014. Zuletzt aufgerufen am 28. Dez. 2015 unter http://www.rki.de/DE/Content/InfAZ/T/Tuberkulose/Download/TB2014.pdf. 2015
2 Michels H, Bartz C. Tuberkulose-Screening im Rahmen der infektionshygienischen Untersuchung Asylbegehrender in Rheinland-Pfalz, Trier. Epid Bull 2015; 11/12: 88-89
3 Rangaka MX, Cavalcante SC, Marais BJ et al. Controlling the seedbeds of tuberculosis: diagnosis and treatment of tuberculosis infection. Lancet 2015
4 Gutsfeld C, Olaru ID, Vollrath O et al. Attitudes about tuberculosis prevention in the elimination phase: a survey among physicians in Germany. PloS one 2014; 9: e112681
5 Lange C, van Leth F, Sester M. Viral load and risk of tuberculosis in HIV-infection. Journal of Acquired Immune Deficiency Syndromes 2016; 71: e51-53
6 Dheda K, Barry CE, 3rd, Maartens G. Tuberculosis. Lancet 2015
7 Schaberg T, Bauer T, Castell S et al. Empfehlungen zur Therapie, Chemoprävention und Chemoprophylaxe der Tuberkulose im Erwachsenen- und Kindesalter. Deutsches Zentralkomitee zur Bekämpfung der Tuberkulose(DZK), Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin (DGP). Pneumologie 2012;66:133-171
8 World Health Organization. Guidelines on the management of latent tuberculosis infection. Zuletzt aufgerufen am 29. Apr. 2016 unter http://www.ncbi.nlm.nih.gov/books/n/wholattb/pdf/. 2015
9 Ringshausen FC, Nienhaus A, Schablon A et al. Frequent detection of latent tuberculosis infection among aged underground hard coal miners in the absence of recent tuberculosis exposure. PloS one 2013; 8: e82005
10 Robert Koch-Institut. Schätzung der Prävalenz und Inzidenz von HIV-Infektionen in Deutschland, Stand Ende 2014. Epid Bull 2015; 45: 475-486
11 Deutsche Gesellschaft für Nephrologie. Hintergrundtext Dialyse. Verfügbar unter http://www.dgfn.eu/presse/downloadbereich/dialyse.html. 2014
12 IGES Institut GmbH. Teil-Indikationsgruppe rheumatoide Arthritis - Anteile der Therapieansätze (2012-2014). In Arzneimittel-Atlas. Berlin. Verfügbar unter http://www.arzneimittel-atlas.de/indikationsgruppen/immunsuppressiva/teil-indikationsgruppe/verbrauch/rheumatoide-arthritis/index_ger.html; 2015
13 Zentrales Knochenmarkspenderregister Deutschland. Spendersuche für deutsche Patienten. Verfügbar unter http://www.zkrd.de/de/presse/zahlen_statistiken_bilder.php. 2015
14 Gray J, Reves R, Johnson S et al. Identification of false-positive QuantiFERON-TB Gold In-Tube assays by repeat testing in HIV-infected patients at low risk for tuberculosis. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America 2012; 54: e20-23
15 Collins LF, Geadas C, Ellner JJ. Diagnosis of Latent Tuberculosis Infection: Too Soon to Pull the Plug on the Tuberculin Skin Test. Annals of internal medicine 2016; 164: 122-124
16 Diel R, Goletti D, Ferrara G et al. Interferon-gamma release assays for the diagnosis of latent Mycobacterium tuberculosis infection: a systematic review and meta-analysis. The European respiratory journal 2011; 37: 88-99
17 Elzi L, Schlegel M, Weber R et al. Reducing tuberculosis incidence by tuberculin skin testing, preventive treatment, and antiretroviral therapy in an area of low tuberculosis transmission. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America 2007; 44: 94-102
18 Centers for Disease Control and Prevention. Recommendations for use of an isoniazid-rifapentine regimen with direct observation to treat latent Mycobacterium tuberculosis infection. MMWR Morbidity and mortality weekly report 2011; 60: 1650-1653
19 Lange C, van Leth F, Sester M et al. Viral Load and Risk of Tuberculosis in HIV Infection. J Acquir Immune Defic Syndr 2016; 71: e51-53
20 Sester M, van Leth F, Bruchfeld J et al. Risk assessment of tuberculosis in immunocompromised patients. A TBNET study. American journal of respiratory and critical care medicine 2014; 190: 1168-1176
21 Pullar ND, Steinum H, Bruun JN et al. HIV patients with latent tuberculosis living in a low-endemic country do not develop active disease during a 2 year follow-up; a Norwegian prospective multicenter study. BMC infectious diseases 2014; 14: 667
22 World Health Organization. Global Tuberculosis Report 2015. Zuletzt aufgerufen am 28. Dez. 2015unter http://apps.who.int/iris/bitstream/10665/191102/ 1/9789241565059_eng.pdf. 2015
23 Robert Koch-Institut. Tuberkulose in Deutschland. Ende des rückläufigen Trends? Epid Bull 2015; 43: 461-463
24 Ziegler R, Just HM, Castell S et al. Infektionsprävention bei Tuberkulose – Empfehlungen des DZK. Pneumologie 2012; 66: 269-282
25 Hermansen TS, Thomsen VO, Lillebaek T et al. Non-tuberculous mycobacteria and the performance of interferon gamma release assays in Denmark. PloS one 2014; 9: e93986
26 Oxford Immunotec. T-Spot.TB - FAQ. Verfügbar unter http://www.tspot.com/faq-2/. 2016
27 Qiagen. Frequently Asked Questions - QuantiFERON TB Gold. Verfügbar unter http://usa.quantiferon.com/irm/content/pdfs/FAQ_QFT_HCP-US_EN_1113_H_LR.pdf. 2016
28 Horsburgh CR, Jr., Barry CE, 3rd, Lange C. Treatment of Tuberculosis. The New England journal of medicine 2015; 373: 2149-2160
29 World Health Organization. Treatment of Tuberculosis Guidelines, Fourth Edition. Zuletzt aufgerufen am 28. Dez. 2015 unter http://www.who.int/entity/tb/publications/tb_treatmentguidelines/en/index.html. 2009
30 World Health Organization. The use of bedaquiline in the treatment of multidrug-resistant tuberculosis. Interim policy guidance. Zuletzt aufgerufen am 28. Dez. 2015 unter http://apps.who.int/iris/bitstream/10665/84879/1/9789241505482_eng.pdf. 2013
31 World
Health Organization. The use of delamanid in the treatment of
multidrug-resistant tuberculosis. Interim policy guidance. Zuletzt
aufgerufen am 28. Dez. 2015
unter
http://www.ncbi.nlm.nih.gov/books/n/whodela/pdf/.
2014










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
