The Liver Meeting, Aasld, Boston, 11.-15. November 2016
 Chronische Hepatitis C – Problem gelöst!
Chronische Hepatitis C – Problem gelöst!
Die Hepatitis C war erneut ein wichtiges Thema des Kongresses, stand aber nicht mehr so im Mittelpunkt wie in den vergangenen Jahren. Die Fettlebererkrankungen NAFLD (nicht-alkoholische Fettleber) und NASH (nicht-alkoholische Steatohepatitis) gewinnen spürbar an Bedeutung. Das hat verschiedene Gründe: Die Prävalenz von NAFLD/NASH in den USA steigt, denn die Amerikaner werden immer dicker und erste Medikamente gegen die Fettlebererkrankungen sind in der Prüfung. Bei der Hepatitis C dagegen scheint das Therapieoptimum erreicht und nur noch wenige Substanzen sind in der Entwicklung. Die Hepatitis B stand in Boston erneut eher im Hintergrund. Es gibt zwar einige spannende Ansätze, doch alles steckt noch in den Babyschuhen.
Die wirkliche Welt
Auf
der Konferenz wurde eine Fülle von „Real World“-Daten aus
verschiedenen Registern präsentiert. Nahezu jedes Land hat
mindestens eine Kohorte. Eine der größten Kohorten ist der
medizinische Datenpool der amerikanischen Veteranen. Die ehemaligen
Soldaten haben eine hohe HCV-Prävalenz. In der vorgestellten Arbeit
wurden die Daten von mehr als 17.000 Personen analysiert, die
zwischen 1/2014 und 6/2015 Interferon-frei behandelt wurden. 80%
hatten GT1, 12% GT2, 7% GT3 und 1% GT4. Knapp 3.000 hatten SOF/RBV,
11.000 SOF/LDV und 3.000 3D mit/ohne Ribavirin erhalten. Die
SVR12-Raten waren mit über 90% bei Genotyp 1 mit/ohne Zirrhose so
gut wie in den klinischen Studien. Patienten mit GT2-4 mit/ohne
Zirrhose hatten deutlich schlechter abgeschnitten
(Ioannou GN et
al., #21).
| Genotyp 1 | n=6.606 | 12 Wochen | SVR 88%-96% |
| Genotyp 1 | n= 976 | 8 Wochen | SVR 96%-99% |
| Genotyp 2 | n=265 | 12 Wochen | SVR 89% |
| Genotyp 3 | n=1.111 | 12/24 Wochen | +VR 80%- 96% |
Tab.1 SVR-Raten aus dem Deutschen Hepatitis C-Register
Eine große und sehr gut dokumentierte Kohorte ist auch das Deutsche Hepatitis C-Register (DHC-R). 10 Arbeiten aus dem Register (n=9.300) wurden präsentiert. Sie belegen, dass die DAA-Therapie auch bei über 70jährigen, HIV/HCV-Koinfizierten und Substitutierten gut funktioniert (Welzel TM et al., #951; Rockstroh J et al., #907; Christensen S et al., #1980). Selbst bei fortgeschrittener Zirrhose (Fibroscan >20 kPa, Thrombozyten <90.000/µl, Albumin <35 g/l) konnten viele Patienten geheilt werden. Ähnlich wie im amerikanischen Register schneidet GT1 deutlich besser ab als die anderen Genotypen (Tab. 1) (Deterding K et al., #904).
Therapieverkürzung
Die Verkürzung der Therapie mit SOF/LDV bei GT1 und einer Viruslast <6 Mio IU/ml funktioniert auch im klinischen Alltag, das zeigen mehrere Kohortenanalysen aus den USA und Deutschland. Eine Verkürzung auf acht Wochen bei therapienaiven Patienten ohne Zirrhose mit GT1b ist auch mit dem 3D-Regime möglich. Das belegt eine Studie, die kurz vor dem Kongress veröffentlicht wurde (Feld et al., Paris HCV Special Conference 2016).
Langzeitdaten
Die neuen DAA sind mittlerweile mehrere Jahre auf dem Markt. Langzeitbeobachtungen sollen den anhaltenden Erfolg und den günstigen Einfluss der SVR auf den Verlauf der Lebererkrankung dokumentieren. So erreichten beispielsweise in TOPAZ-I Patienten mit GT1 durch 3D 97% (ohne Zirrhose) bzw. 96% mit Zirrhose die SVR. Die SVR hatte einen günstigen Einfluss auf die Leberfibrose (Fibroscan F3 -2,75 kPa; F4 -6,45 kPA) (Agarwal K et al., #865). Selbst Patienten mit fortgeschrittener Zirrhose profitieren von der Elimination von HCV. Eine Beobachtung von über 1.000 geheilten Patienten mit Zirrhose Child A-C über 3-4 Jahre zeigte einen Abfall des Bilirubins und Anstieg des Albumins. Das Stadium der Lebererkrankung blieb meist gleich oder besserte sich (Muir A et al., #880).
HCC nicht häufiger
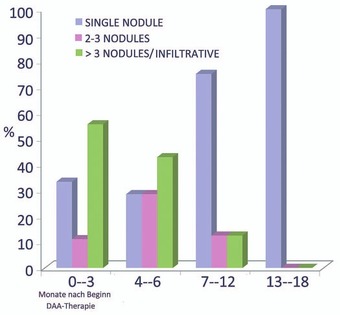
Abb. 1 Zeitpunkt der Diagnose des HCC bei DAA-Therapie
Auf dem EASL wurde diskutiert, ob die DAA-Therapie die Entstehung von hepatozellulären Karzinomen begünstigt. Dies scheint nicht der Fall zu sein. In einer italienischen Studie wurden 3.000 Patienten bis zu 400 Tage nach DAA-Therapie prospektiv untersucht. 41 Patienten entwickelten ein HCC und damit nicht mehr als erwartet. Unerwartet war jedoch das vergleichweise aggressivere Wachstum der Tumoren: 12% der Patienten hatten 2-3 Knoten, 40% hatten mehr als 3 Knoten bzw. infiltratives Wachstum, 12% eine Pfortaderthrombose und 10% Fernmetastasen. Die multilokulären Tumore wurden häufiger in der frühen Phase während oder nach DAA-Therapie beobachtet, so dass man davon ausgeht, dass der Tumor bereits vor Behandlungsbeginn vorhanden war (Abb. 1). Risikofaktoren für ein HCC waren wie erwartet eine Zirrhose sowie ein Nicht-Ansprechen der DAA Therapie (Romano A et al., #19).
Dialyse
Sofosbuvir sollte bei Patienten mit einer eGFR <30 ml/Min nicht eingesetzt werden. Eine „leichte“ (eGFR 50-80 ml/Min) oder „moderate“ (eGFR 30-49 ml/Min) Niereninsuffizienz erhöht zwar die AUC des Sofosbuvir-Metaboliten um 55% bzw. 88%, führt einer retrospektiven Analyse zufolge aber nicht zu relevanten Nierenproblemen (Durand F et al., #867). Elbasvir/Grazoprevir hat selbst bei stark eingeschränkter Nierenfunktion keine negativen Auswirkungen (Reddy K et al., #889) und heilte in der großen Studie C-Surfer (n=134) 99% der Patienten mit GT 1(EASL 2015, Roth D et al., #LP02). Das 3D-Regime hat ebenfalls keinen Einfluss auf die Nierenfunktion und heilte in RUBY-II alle 17 Patienten GT1/4 (mITT) mit fortgeschrittener Nierenerkrankung bzw. an der Dialyse (Gane E et al., # 935). Das AbbVie-Nachfolgeregime Glecaprevir/ Pibrentasvir funktioniert genauso gut. In EXPEDITION-4 erhielten 104 Patienten GT 1-6 mit/ohne Zirrhose 12 Wochen die Fixkombination und alle wurden geheilt (mITT 100%) (Gane E et al., #LB-11).
GT3 und Zirrhose
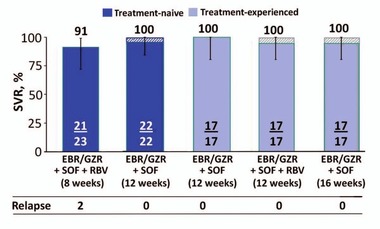
Abb. 2 C-ISLE: Elbasvir/Grazoprevir + Sofosbuvir + Ribavirin bei naiven/vorbehandelten Patienten GT3 und Zirrhose. SVR12-Raten
Schwierig ist derzeit noch die Behandlung von Patienten mit GT3 und Zirrhose. In Zukunft (d.h. in weniger als einem Jahr vorraussichtlich) kann man diese Patienten wahrscheinlich alle heilen. Doch heute? Hier präsentierte Graham Foster, London, ein Regime, das man „gleich morgen in der Praxis einsetzen kann!“: Grazoprevir/Elbasvir/Sofosbuvir mit Ribavirin 8 Wochen und ohne Ribavirin 12 Wochen (Anm. d. Redaktion: sofern der Kostenträger zahlt). Die Patienten in C-ISLE (n=100) hatten eine fortgeschrittene Zirrhose (Fibroscan 25 kPA, 24% Thrombozyten <100.000/µl). Es gab nur zwei Relapser im 8-Wochen-Arm (SVR 91%), alle anderen Patienten wurden auch ohne Ribavirin geheilt. Ein Relapser hatte eine Y93-Mutation. Die anderen drei Patienten mit Y93 wurden geheilt (Abb. 2) (Foster G et al., #74).
Wie geht es weiter?
Neuer Statistik-Trend: mITT
Die Patientenzahlen in den pangeno-typischen Studien sind mit meist über mehreren Hundert nicht gering, doch in den einzelnen Subgruppen nach Genotyp, Zirrhose, usw. bleiben dann häufig nur noch wenige Patienten übrig. Bei einer geringen Patientenzahl drückt dann schon ein einziger Relaps die SVR-Rate unter 95%. Doch es gibt ja die mITT-Analyse, mit der man dies Problem beheben kann. Die mITT (modified intention to treat)-Analyse ist nicht so klar definiert wie die ITT-(intention to treat) oder PP-(per protocol)-Analyse. Bei mITT können die Autoren selbst festlegen, welche Patienten aus welchem Grund nicht in die Analyse eingeschlossen werden. Es lohnt sich also, auch mal das Kleingedruckte auf den Dias zu lesen.
In den USA – so eine Auswertung der Daten mehrerer Krankenversicherer – wurden in der ersten Zeit nach Einführung der DAA von 1/2015 bis 8/2015 nicht einmal 6% der HCV-Infizierten behandelt. Diese niedrige Rate ist im Wesentlichen auf die fehlende Kostenübernahme durch die Kassen zurückzuführen. Dass Schwarze seltener behandelt wurden, liegt in erster Linie an ihren schlechteren Versicherungsstatus (Spradling PR et al., #20). Vor diesem Hintergrund wirkt auch der Ansatz, die Therapie von „Nurse Practitioners“ durchführen zu lassen, was in einer Studie untersucht wurde, eher hypothetisch (Emmanuel B et al., #22). Zumindest zeigen diese Daten, dass das Potential an Patienten in den USA noch immens ist – im Gegensatz zu Deutschland, wo die Behandlungszahlen stark rückläufig sind.
In der Pipeline
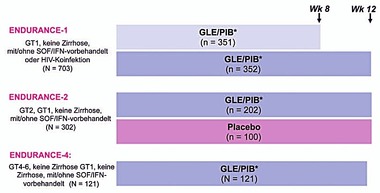
Abb. 3 Studien ENDURANCE-1, 2, 4: Glecaprevir/Pibrentasvir bei GT1, 2, 4, 5, 6
In der Pipeline sind derzeit einige pangenotypische Regime, die voraussichtlich 2017/18 zugelassen werden. Sie sind alle hocheffektiv und sehr gut verträglich. Das heißt konkret: Es werden nur noch einzelne Patienten versagen und diese kann man dann mit einem anderen Regime doch noch retten. Was bleiben bzw. vermutlich noch schwieriger wird: Für jede Situation gibt es mehrere mögliche Optionen und damit die Qual der Wahl für den Arzt. Ein Lichtblick: Man muss sich nicht mehr so viele schwierige Substanznamen merken, alles wird abgekürzt.
Regime G/P
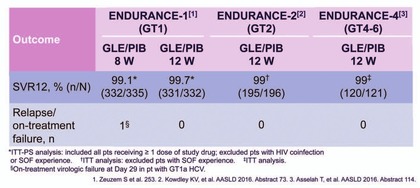
Abb. 4 Studien ENDURANCE 1, 2 und 4: Glecaprevir/Pibrentasvir bei GT1, 2, 4, 5, 6
AbbVie
geht mit zwei neuen Substanzen der zweiten Generation ins Rennen. Die
Fixkombination G/P zur einmal täglichen Gabe enthält den
Proteasehemmer Glecaprevir und den NS5A-Inhibitor Pibrentasvir. Beide
Substanzen haben eine hohe Resistenzbarriere, werden kaum
metabolisiert und biliär ausgeschieden. Die Dosierung beträgt drei
Tabletten G/T (100 mg/40 mg) einmal täglich. In den Studien
ENDURANCE wurden Patienten ohne Zirrhose (naiv oder IFN/SOF-erfahren)
behandelt. Die SVR-Raten nach 12 Wochen Behandlung lagen bei allen
Genotypen im Bereich von rund 99%. Bei Patienten ohne Zirrhose ist es
sogar möglich die Behandlung auf 8 Wochen zu verkürzen: Bei GT1
(n=703) wurde lediglich ein einziges virologisches Versagen
beobachtet, wobei hier möglichweise, so Stefan Zeuzem, mangelnde
Compliance der Grund sein könnte. Die Höhe der Viruslast und
Baseline-RAVs hatten bei der Verkürzung keinen Einfluss auf den
Therapieerfolg. Bei GT 2-6 (176 naiv und 27 IFN- bzw. SOF-erfahren)
lag die SVR nach 12 Wochen Therapie bei 99%. Zwei vorbehandelte
Patienten mit GT2a hatten einen Relaps. (Abb. 3 und 4) (Zeuzem S et
al., #235; Kwodely KV et al., 73# ; Asselah T et al., #114, Tarek H
et al., #LB-15).
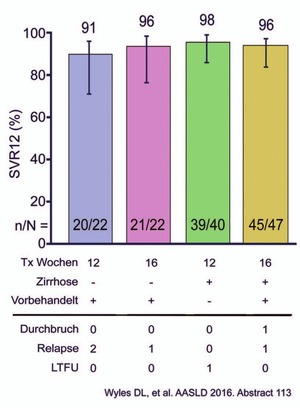
Abb. 5 SURVEYOR-II Teil 3: GT3 naiv/vorbehandelt sowie mit/ohne Zirrhose. SVR12 nach 12 bzw. 16 Wochen Glecaprevir/Pibrentasvir ohne Ribavirin
In der am schwierigsten zu behandelnden Situation, nämlich bei GT3 mit/ohne kompensierter Zirrhose sowie naiv/vorbehandelt wurde G/P ohne Ribavirin 12 bzw. 16 Wochen eingesetzt (n=131). Bei den therapienaiven Patienten reichen 12 Wochen G/P aus. Die SVR lag bei 98%. Vorbehandelte Patienten könnten von der längeren Behandlung profitieren (SVR 96%) (Abb. 5) (Wyles D et al., #115). Die Verträglichkeit von P/G war sehr gut. Lediglich bei wenigen Patienten (<1%) wurde eine mäßige Hyperbilirubinämie beobachtet, die auf den Metabolismus des Proteasehemmers zurückgeht.
Regime S/V/V
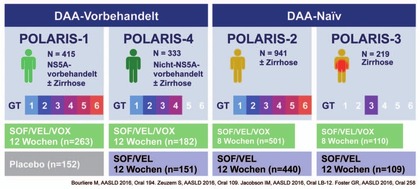
Abb. 6 Phase-3-Studien POLARIS zu Sofosbuvir/Velpatasvir/Voxilaprevir
Gilead
Sciences hat das auf dem Markt befindliche Regime
Sofosbuvir/Velpatasvir (S/V) um den Proteasehemmer Voxilaprevir
ergänzt (Fixkombination Sofosbuvir/Velpatasvir/Voxilaprevir =
S/V/V). Die Dosierung beträgt S/V/V (400 mg /100 mg/100 mg) einmal
täglich. Vorgestellt wurden die Phase-3-Studien POLARIS 1-4 (Abb.
6). In POLARIS-1 kam es bei NS5A- vorbehandelten Patienten (n=263)
mit GT1-6 nach 12 Wochen S/V/V in sechs Fällen zum Relaps (4 GT3, 1
GT1a, 1 GT4). Die SVR betrug somit 96% (Bourliere M et al., #194). In
POLARIS-4 erhielten 333 vorbehandelte (nicht-NS5A) Patienten mit GT
1-4 jeweils 12 Wochen S/V/V oder S/V. Hier gab es unter der
2er-Kombination 15 Versager und unter der 3er-Kombination nur einen
dokumentierten Relaps. Der Unterschied ging im wesentlichen auf
häufigere Relapse bei GT1a und 3 zurück. 10/15 Relapser nach S/V
entwickelten eine Y93-RAV. Der Patient mit Relaps nach S/V/V hatte
keine RAVs. (Zeuzem S et al., #109).
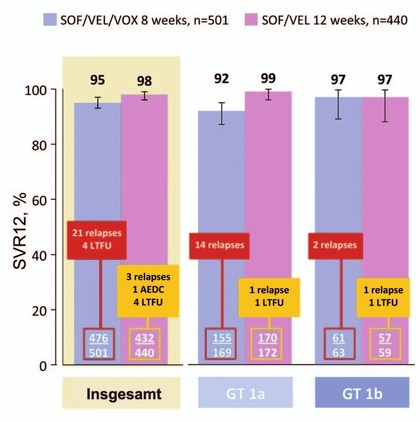
Abb. 7 POLARIS-2. 8 Wochen Sofosbuvir/Velpatasvir/Voxilaprevir vs. 12 Wochen Sofosbuvir/Velpatasvir. SVR12-Raten
In POLARIS-2 wurde versucht, bei therapienaiven Patienten GT 1-6 auf 8 Wochen zu verkürzen. Statistisch wurde das Ziel der Nicht-Unterlegenheit NICHT erreicht. Nach 8 Wochen S/V/V kam es bei 21 Patienten zum Relaps im Vergleich zu 3 Relapsern nach 12 Wochen S/V. Besonders deutlich war der Unterschied bei GT1a (14 vs 1 Relaps) und bei Zirrhose (14 vs 7 Relaps) (Abb. 7) (Jacobsen I et al., # LB-12). In POLARIS-3 wurde S/V/V 8 Wochen mit S/V 12 Wochen bei den besonders schwer zu behandelnden Patienten mit GT3 und Zirrhose (n=219) verglichen. Die Regime waren gleich gut (SVR 99% vs 96%), wobei vorbehandelte Patienten mehr profitierten (97% vs 91%) (Foster G et al., # 258). Die Verträglichkeit der neuen Fixkombination war gut. Lediglich Durchfälle und Übelkeit wurden etwas häufiger beobachtet. Die Nebenwirkungen waren mild und führten nicht zum Abbruch der Behandlung.
Regime MK3
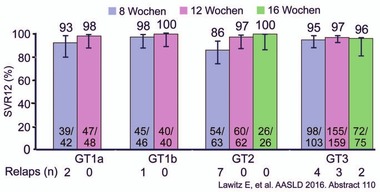
Abb. 8 C-CREST 1 & 2: MK-3682/Grazoprevir/Ruzasvir ± RBV 8, 12 oder 16 Wochen bei Patienten mit GT1-3. SVR-Raten. Zirrhose, Ribavirin, Vorbehandlung hatte keinen Einfluss auf die SVR
MSD
ergänzt den Proteasehemmer Grazoprevir mit dem
Zweitgenerations-NS5A-Hemmer Ruzasvir und einem NS5B-Hemmer MK-3682.
Die Fixkombination MK3 wird in Form von zwei Tabletten (225 mg/50
mg/30 mg) einmal täglich eingenommen. Das Regime wird u.a. in den
C-CREST-Studien geprüft. Zwei Studien wurden präsentiert, in denen
MK3 seine hohe Potenz auch bei mehreren DAA-RAVs bewies. In C-CREST
1&2 wurden Patienten (n=664) mit/ohne Zirrhose 8, 12, oder 16
Wochen mit MK3 mit/ohne Ribavirin behandelt. 8 Wochen Therapie
reichen aus bei GT1 und 3 (SVR 97% und 96%). Selbst von den
vorbehandelten GT3-Patienten mit Zirrhose erreichten 99% nach einer
achtwöchigen Therapie die SVR. Dagegen scheint man bei GT2 länger,
nämlich 12 Wochen behandeln zu müssen (86% vs 97% vs 100%).
Ribavirin hatte keinen Einfluss auf das Ergebnis (Abb. 8) (Lawitz E
et al., # 110). Alle 23 Patienten, bei denen 8 Wochen Therapie nicht
ausreichten, wurden 12 Wochen mit MK3 behandelt und alle erreichten
die SVR (Sefarty L et al., #112).
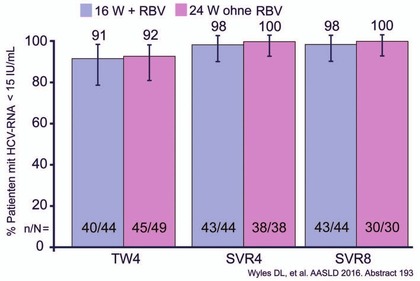
Abb. 9 C-SURGE: MK-3682/Grazoprevir/Ruzasvir bei DAA-Versagern (inklusive NS5A-Hemmer) SVR8-Raten
In C-SURGE erhielten 94 GT1-Patienten (43% Zirrhose) nach Versagen auf SOF/LDV oder EBR/GRZ 16 Wochen MK3 mit oder 24 Wochen MK3 ohne Ribavirin. 84% hatten mindestens eine NS5A-RAV, 4% hatten drei und mehr NS5A-RAVs, 55% hatten NS5A- und NS3-RAVs und 40% hatten eine Y93. Die SVR8 betrug 98% bei 16 Wochen ohne Ribavirin und 100% bei 24 Wochen ohne Ribavirin (Abb. 9) (Wyles D et al., #193). Die Verträglichkeit von MK3 war sehr gut, es gab keine auffälligen Nebenwirkungen.
Und sonst noch?
Auch Janssen hat noch ein Regime in der Pipeline. Die 3er-Kombination besteht aus Simeprevir plus dem NS5A-Hemmer Odalasvir und AL-335, einem NS5B-Inhibitor. GSK stellte einen pangenotypischen langwirksamen NS5B-Inhibitor (GSK2878175) vor, der parenteral gegeben wird. Die im Programm angekündigte Arbeit zu anti-miR RG-101 wurde zurückgezogen. Die FDA hatte die Studie nach einer schweren Nebenwirkung gestoppt.
Hepatitis B
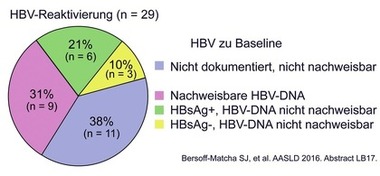
Abb. 10 HBV-Reaktivierung bei DAA-Therapie
Zur Hepatitis B gab es vergleichsweise wenig Arbeiten. Dennoch gab es einige Neuigkeiten. Viel beachtet wurde ein Bericht der FDA über 29 Fälle einer Hepatitis B-Reaktivierung nach Ausheilung der Hepatitis C. Die meisten Reaktivierungen passierten in den ersten 4-8 Wochen nach Therapiestart, zum Teil mit gravierenden Folgen. Zwei Patienten starben, einer wurde transplaniert. 9 Patienten hatten vorher keine nachweisbare HBV-DNA im Blut. Deshalb empfiehlt die Behörde, alle Patienten vor Behandlung der Hepatitis C auf Hepatitis B zu screenen und bei nachweisbarer HBV-DNA eine entsprechende Therapie einzuleiten bzw. zu überwachen (Abb. 10) (Bersoff-Matcha SJ et al., #LB-17).
Neue Substanzen auf dem Weg zur Heilung der Hepatitis B sind u.a. der TLR-9-Agonist GS-9620. In einer Phase-2-Studie (n=26) kam es zwar zu einem Anstieg der spezifischen T-Zell-antworten aber nicht zu einem dauerhaften Abfall von HBs-Antigen (Boni C et al., #13). Auch eine Phase-2-Studie mit der adjuvanten T-Zell-Vakzine GS-4774 in Kombination mit Tenofovir zeigte keine überzeugende Wirkung auf HBsAntigen (Janssen HL et al., #231). Bei der Hepatitis Delta gab es eine Proof-of-Concept Arbeit zu Myrcludex (Bogolomov et al., #229) und eine Dosisfindungsstudie zu Lonafarnib (Wedemeyer H et al., #230).










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
