Marcus Hentrich, München
Hodentumoren mit und ohne HIV
Keimzelltumoren
(KZT) des Hodens sind der häufigste bösartige Tumor bei Männern im
Alter von 25 bis 45 Jahren. Bei einer Inzidenz von 10.3 / 100.000
Einwohner werden 2018 in Deutschland ca. 4.400 neu diagnostizierte
Fälle auftreten.1
Hodentumoren zeichnen sich durch hohe Heilungsraten auch in
fortgeschrittenen Tumorstadien aus. Die
relative
10-Jahres-Überlebensrate beträgt ca. 95%, womit es sich um eines
der prognostisch günstigsten Malignome überhaupt handelt. Grund für
die auch in fortgeschrittenen Stadien erzielten hohen Heilungsraten
ist die sehr hohe Empfindlichkeit der Tumorzellen auf das
Zytostatikum Cisplatin.2
Pathologisch werden Seminome (ca. 60% aller KZT) von Nicht-Seminomen unterschieden. Zu letzteren zählen Teratome, Embryonalzellkarzinome, Chorionkarzinome, Dottersacktumoren und Mischtumoren, die auch Seminom-Anteile aufweisen können.
Diagnose

Abb. 1 Großer Hodentumor, vom Patienten über ca. 2 Jahre beobachtet
In der Regel werden Hodentumoren als schmerzlose Raumforderung im Bereich des Hodens bemerkt (Abb. 1). Circa 30-40% der Patienten beklagen Missempfindungen oder einen dumpfen Schmerz im Skrotum oder Unterbauch, während in ca. 10% Metastasen-bedingte Symptome wie Schmerzen im Lumbalbereich – hervorgerufen durch retroperitoneale Lymphknotenvergrößerungen – zur Diagnose führen. Neben der klinischen Untersuchung und einer Sonographie des Hodens sind ein CT von Abdomen und Thorax sowie die Bestimmung der Tumormarker AFP (alpha Fetoprotein), ß-HCG (ß-Untereinheit des Choriongonadotropins) und der LDH erforderlich. Seminome können in bis zu 30% der Fälle ß-HCG positiv, jedoch nie AFP-positiv sein.
Therapie
Im Regelfall erfolgt vor jeder weiteren Therapie eine inguinale Orchiektomie. Seminome und Nichtseminome werden stadien- und risikoadaptiert behandelt. Bei Seminomen im Stadium I (Tumor auf den Hoden begrenzt) führen eine aktive Surveillance, d.h. eine alleinige Nachsorge, oder eine adjuvante Chemotherapie mit 1-2 Zyklen Carboplatin zu Heilungsraten von > 98% (Abb. 2). Die Strahlentherapie wurde bei diesen Patienten wegen der hiermit verbundenen erhöhten kardiovaskulären Morbidität und der erhöhten Rate an Zweitmalignomen weitgehend verlassen. Patienten mit Nichtseminom im Stadium I können ebenfalls einer Surveillance oder – bei Vorliegen einer lymphovaskulären Invasion durch Tumorzellen – einer adjuvanten Chemotherapie mit 1 Zyklus Chemotherapie nach dem PEB-Schema (Cisplatin, Etoposid, Bleomycin) zugeführt werden.3,4
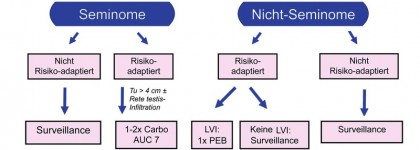
Abb. 2 Vorgehen bei Patienten mit Hodentumoren im Stadium I
Die Therapie fortgeschrittener Keimzelltumore richtet sich nach der Risikoeinteilung der International Germ Cell Cancer Collaborative Group (IGCCCG). Hierbei werden neben der Histologie die Höhe der Tumormarker, die Primärlokalisation des Keimzelltumors und das Metastasierungsmuster zur Prognoseeinschätzung herangezogen. Patienten mit günstigem Risiko erhalten drei, Patienten mit intermediärem oder hohem Risiko 4 Zyklen Chemotherapie nach dem PEB-Protokoll, jeweils in streng 3-wöchigen Intervallen. Die Heilungsraten in fortgeschrittenen Stadien reichen von ca. 60% bei Patienten mit ungünstiger Prognose nach IGCCCG bis >90% bei Patienten mit günstiger Prognose. Bei Nichtseminomen sollten nach erfolgter Chemotherapie Tumorresiduen von mindestens 1 cm Größe operativ entfernt werden.3,4
| HIV/AIDS | Untersuchungs- Zeitraum | SIR / SRR | Reference |
|---|---|---|---|
| HIV | 1985 - 2002 | 1.6 (0.6-3.5) | Clifford 2005 [5] |
| AIDS | 1996 - 2002 | 0.7 (0.2-1.6) | Engels 2006 [6] |
| AIDS | 1990 - 2000 | 1.4 (0.8-2.2) | Hessol 2007 [7] |
| HIV | 1980 - 2003 | 1.7 (1.5-1.9)
1.9 (1.6-2.2) testis S 1.3 (0.96-1.7) testis NS 2.5 (1.1-5.0) extratestis S | Goedert 2007 [8] |
| HIV/AIDS | 1980 - 2003 | 1.4 (1.0-1.8) | Grulich 2007§ [9] |
| HIV | 1992 - 2003 | 1.6 (0.9.2.7) | Patel 2008 [10] |
| HIV | 2002 -2007 | 2.15 (0.6-5.5) | Powles 2009 [11] |
| HIV | 1984 - 2007 | 2.5 (1.0-5.1) | Seaberg 2010 [12] |
| HIV/AIDS | 2002 - 2006 | 0.5 (0.0-3.1) | Franceschi 2010 [13] |
| AIDS | 1980 - 2007 | 1.4 (1.3-1.6)
1.4 (1.3-1.7) testis S 1.2 (1.0-1.4) testis NS | Shiels 2012 [14] |
| HIV | 1999 - 2009 | 3.1 (1.5-6.5) | Calabresi 2013 [15] |
| HIV | 1986 - 2012 | 2.4 (1.4-3.7) | Raffetti 2015 [16] |
| S = Seminom; NS = nicht-Seminom; § = Daten einer Metaanalyse | |||
Tab. 1 Relative Inzidenzraten (standardized incidence ratio, SIR) bei Patienten mit Hodentumoren und HIV
Für Patienten mit Rezidiv ihres KZT stehen entweder eine konventionelle Salvage-Chemotherapie (KDCT) oder eine Hochdosischemotherapie (HDCT) mit Transplantation autologer Blutstammzellen zu Verfügung. Als KDCT werden 4 Zyklen Cisplatin/Ifosfamid/Paclitaxel (TIP) oder Cisplatin/Etoposid/Ifosfamid (PEI) verabreicht. Bei der HDCT folgen auf 1-2 Zyklen konventionelle Chemotherapie mit Mobilisierung und Gewinnung peripherer Blutstammzellen 3 Zyk-len einer HDCT mit Carboplatin/Etoposid. Um eine zeitgerechte Regeneration der Hämatopoese zu gewährleisten, werden nach jeder HDCT periphere autologe Blutstammzellen retransfundiert. Im ersten Rezidiv führte die HDCT in einer retrospektiven Analyse von >1.500 Patienten gegenüber der konventionellen Chemotherapie zu einem signifikant besseren progressionsfreien Überleben und Gesamtüberleben.
Hodentumoren und HIV
Registerstudie HIV und Hodentumoren
Vor dem Hintergrund der unzureichenden Datenlage zu Patienten mit HIV und Hodentumoren wurde von der Interdisziplinären Arbeitsgruppe Hodentumoren in der DKG in Zusammenarbeit mit dem Arbeitskreis HIV-Neoplasien der DGHO eine Registerstudie zu HIV-assoziierten Hodentumoren initiiert. Hauptziel dieser Studie ist es, Remissions- und Überlebensraten von HIV-Patienten mit Keimzelltumoren, die nach 1996 diagnostiziert und behandelt wurden, zu analysieren. Durch Erhebung von Daten zu Erkrankungs-Charakteristika, Art, Durchführung und Toxizität der antineoplastischen Therapie sowie von auf die HIV-Infektion bezogener Parameter wie Verlauf der CD4-Zellzahl und HIV-RNA soll u.a. untersucht werden, ob die Behandlung des KZT trotz der bekannten HIV-Infektion standardgerecht durchgeführt werden konnte. Zudem wird der Einfluss der antineoplastischen Therapie auf den Verlauf der HIV-Infektion untersucht und durch einen Literaturvergleich geprüft, ob sich die Gesamtüberlebensrate von Patienten mit HIV weiter an die hohen Überlebensraten von HIV-negativen Patienten mit KZT angenähert hat.
Einschlusskriterien für die Studie sind
- Histologisch gesicherter Keimzelltumor (KZT)
- Erstdiagnose des KZT nach 01.01.1996
- Gesicherte Infektion mit HIV zum Zeitpunkt der Diagnose des KZT
- Männliches Geschlecht
- Alter ≥ 18 Jahre
Bisher wurden 80 Patienten eingeschlossen und bei 52% war der Tumor auf den Hoden begrenzt (Stadium I). Die Studie rekrutiert auch international und ist für weitere Patienten offen. Es liegen verschiedene Ethikvoten vor.
Wir
freuen uns über die Meldung weiterer Patienten.
Kontakt:
Prof.
Dr. Marcus Hentrich · Tel. 0 89 / 1303 4372
E-Mail:
marcus.hentrich@swmbrk.de
Bei Patienten mit HIV ist das Risiko für einen KZT im Vergleich zu HIV-negativen Männern um das 1,5-3-fache erhöht (Tab. 1). Eine Analyse der US-amerikanischen HIV/AIDS Cancer Match Study zeigte eine signifikante Erhöhung des Risikos für Seminome und extragonadale KZT, nicht aber für nichtseminomatöse KZT.8 Die Schwere der Immunsuppression scheint ebenso wie die Dauer der HIV-Infektion kein relevanter Risikofaktor zu sein (mediane CD4-Zellzahl bei Erstdiagnose des KZT 261/µl-325µl).17-20 Seminome (S) treten häufiger auf als Nichtseminome (NS) und die Mehrheit der Patienten (ca. 60%) werden im Stadium I diagnostiziert.20
Die Überlebensraten HIV-infizierter Patienten mit KZT waren vor Verfügbarkeit kombinierter antiretroviraler Therapien (cART) deutlich schlechter als bei HIV-negativen Patienten.16,20 Dies lag maßgeblich an schweren infektiösen Komplikationen unter der Chemotherapie, aber auch an häufigen Dosisreduktionen oder Intervallverlängerungen zwischen den Chemotherapiezyklen, die den Erfolg einer Chemotherapie bei Patienten mit KZT deutlich einschränken.18
Das Überleben von Patienten mit HIV-KZT dürfte sich in der cART-Ära deutlich verbessert haben, allerdings gibt es hierzu bisher keine aussagekräftigen Untersuchungen. Die einzige Fall-Kontroll-Studie, die in der cART-Ära publiziert wurde, zeigte keinen Unterschied mehr im krebsspezifischen Überleben zwischen HIV-infizierten Patienten (n=35) und HIV-negativen Kontrollen (n=105).21 Wegen HIV-assoziierten Komplikationen wie schwerwiegenden Infekt-Komplikationen oder AIDS-bedingten Todesfällen war das Gesamt-überleben von Patienten mit HIV allerdings signifikant schlechter als das HIV-negativer Patienten. Die Aussagekraft dieser Studie ist jedoch dadurch eingeschränkt, dass lediglich 13 der 35 HIV-Patienten in der HAART bzw. cART-Ära behandelt wurden.21
Therapie bei HIV
Grundsätzlich sollte sich die Primärtherapie von Patienten mit KZT unabhängig vom HIV-Status nach internationalen Empfehlungen richten.3,4 Zur Therapie von Patienten mit HIV und KZT-Rezidiv gibt es kaum Erfahrungen, grundsätzlich sollte sie aber ebenfalls dem Vorgehen bei HIV-negativen Patienten mit KZT entsprechen.22
Während einer Chemo- oder Strahlentherapie ist die Fortführung bzw. Einleitung einer ART unter Beachtung möglicher pharmakologischer Interaktionen sinnvoll, da es in Einzelfällen zu einer deutlichen Steigerung der Chemotherapie-assoziierten Toxizität kommen kann.23 Auch wegen ihres geringen Interaktionspotentials sind Integrase-Inhibitoren in Kombination mit NRTIs eine gute Wahl. Unter der Chemotherapie geht die Zahl der CD4-Zellen in der Regel zurück, wobei das Ausmaß des Rückgangs von der Intensität und der Dauer der Chemotherapie abhängt. Eine primäre Prophylaxe mit G-CSF ist nicht erforderlich.
1 Robert Koch-Institut. Krebs in Deutschland 2013/ 2014. 11. Ausgabe. Berlin 2017:96-9
2 Hanna NH, Einhorn LH. Testis cancer – dicoveries and updates. N Engl J Med 2014;371:2005-16
3 Beyer J, Albers P, Altena R, et al. Maintaining Success, Reducing Treatment Burden, Focussing on Survivorship: Highlights from the Third European Consensus Conference on Diagnosis and Treatment of Germ Cell Cancer. Ann Oncol 2013;24:878-88
4 Albers P, Albrecht W, Algaba F, et al. Guidelines on Testicular Cancer: 2015 Update. Eur Urol 2015;68:1054-68
5 Clifford G, Polesel J, Rickenbach M, et al. Cancer risk in the Swiss HIV Cohort Study: associations with immunodeficiency, smoking, and highly active antiretroviral therapy. J Natl Cancer Inst 2005;16:425-32
6 Engels EA, Pfeiffer RM, Goedert JJ, et al. Trends in cancer risk among people with AIDS in the United States 1980-2002. AIDS 2006;20:1645-54
7 Hessol NA, Pipkin S, Schwarcz S, et al. The impact of highly active antiretroviral therapy on non-AIDS-defining cancers among adults with AIDS. Am J Epidemiol 2007;165:1143-53
8 Goedert JJ, Purdue MP, McNeel TS, et al. Risk of Germ cell tumors among men with HIV/acquired immunodeficiency syndrome. Cancer Epidemiol Biomarkers Prev 2007;16:1266-9
9 Grulich AE, van Leeuwen MT, Falster MO, Vajdic CM. Incidence of cancers in people with HIV/AIDS compared with immunosuppressed transplant recipients: a meta-analysis. Lancet 2007;370:59-67
10 Patel P, Hanson DL, Sullivan PS, et al. Incidence of types of cancer among HIV-infected persons compared with the general population in the United States, 1992–2003. Ann Intern Med 2008;148:728-36
11 Powles T, Robinson D, Stebbing J, et al. Highly active antiretroviral therapy and the incidence of non–AIDS-defining cancers in people with HIV infection. J Clin Oncol 2009;27:884-90
12 Seaberg EC, Wiley D, Martinez-Maza O, et al. Cancer incidence in the Multicenter AIDS Cohort Study before and during the HAART era. Cancer 2010;116:5507-16
13 Franceschi S, Lise M, Clifford GM, et al. Changing patterns of cancer incidence in the early- and late-HAART periods: the Swiss HIV Cohort Study. Br J Cancer 2010;103:416-22
14 Shiels MS, Engels EA. Increased risk of histologically defined cancer subtypes in human immunodeficiency virus–infected individuals. Cancer 2012; 118: 4869-76
15 Calabresi A, Ferraresi A, Festa A, et al. Incidence of AIDS-defining cancers and virus-related and non-virus-related non-AIDS-defining cancers among HIV-infected patients compared with the general population in a large health district of northern Italy, 1999–2009. HIV Medicine 2013;14:481-90
16 Raffetti E, Albini L, Gotti D, et al. Cancer incidence and mortality for all causes in HIV-infected patients over a quarter century: a multicentre cohort study. BMC Public Health 2015;235
17 Bernardi D, Salvioni R, Vaccher E et al. Testicular germ cell tumors and human immunodeficiency virus infection: a report of 26 cases. J Clin Oncol 995;13:2705-11
18 Fizazi K, Amato R, Beuzeboc P et al. Germ cell tumors in patients infected by the human immunodeficiency virus. Cancer 2011;92:1460-7
19 Powles T, Bower M, Daugaard G et al. Multicenter study of human immunodeficiency virus–related germ cell tumors. J Clin Oncol 2003;21:1922-7
20 Hentrich M, Brack NG, Schmid P et al. Testicular germ cell tumors in patients with human immunodeficiency virus infection. Cancer 1996;77:2109-16
21 Powles T, Bower M, Sharnash J et al. Outcome of patients with HIV-related germ cell tumours: a case-control study. Br J Cancer 2004 ;90:1526-30
22 Hentrich M, Schiel X, Niedermaier A et al. Successful salvage high-dose chemotherapy and autologous stem cell transplantation in HIV-related germ cell tumor. Ann Oncol 2009;20:1900-1
23 Rudek MA, Flexner C, Ambinder RF. Use of antineoplastic agents in patients with cancer who have HIV/AIDS. Lancet Oncol 2011;12: 905-12











 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
