Susanne Wiebecke, Petra Schulze und Hartwig Klinker, Würzburg
Gewichtszunahme unter Dolutegravir?
Während in der Prä-HAART-Ära opportunistische Infektionen und das Wasting der Patienten ganz wesentlich den klinischen Verlauf der HIV-Erkrankung bestimmten, sind in Zeiten einer hoch wirksamen antiretroviralen Therapie mit konsekutiv langer Lebensperspektive HIV-infizierter Menschen Komorbiditäten zunehmend in den Fokus des Langzeitmanagements gerückt. Eine Schlüsselrolle kommt hierbei einer übermäßigen Gewichtszunahme der Patienten zu, die häufig mit metabolischen Störungen und kardiovaskulären Komplikationen assoziiert ist. Neben HIV-unabhängigen Faktoren, wie sie auch bei nicht HIV-infizierten Menschen anzutreffen sind, werden die ART insgesamt, die verschiedenen Substanzklassen und auch Einzelsubstanzen mit der Induktion von Übergewicht und Adipositas in Verbindung gebracht. Dabei stützen sich die Erkenntnisse vor allem auf retrospektive Kohortenanalysen.
Untersuchungen zum Thema „ART-assoziierte Gewichtszunahme/Übergewicht/Adipositas“ waren in den vergangenen Jahren Gegenstand einer zunehmenden Zahl an Publikationen. Hierbei besteht eine zeitliche Koinzidenz zur breiten Etablierung Integrase-Inhibitor-basierter ART-Regime. Als Einzelsubstanz wurde wiederholt Dolutegravir (DTG) eine besondere Bedeutung im Hinblick auf eine Gewichtszunahme zugesprochen. Der folgende Beitrag gibt einen Überblick über die aktuelle Datenlage.
Gewicht vor und unter ART
Bei vielen HIV-Infizierten, insbesondere bei fortgeschrittener Infektion, ist eine Zunahme des Körpergewichtes erwünscht und klinisches Zeichen der Wirksamkeit einer ART. Sie ist in aller Regel begleitet von einer drastischen Reduktion der Virusbelastung und einer Immunrekonstitution. Yuh et al. (2015) untersuchten Patienten der Veteran Aging Cohort Study (VACS), die zwischen 2000 und 2008 bei 187 CD4-Zellen/µl im Median eine ART begonnen hatten. Es handelte sich um 4.184 Männer und 127 Frauen im Alter von 48 ± 10 Jahren. Ein Jahr nach Therapiebeginn war das Körpergewicht median um 2,7 kg angestiegen. Bei zuvor unter- und normalgewichtigen Patienten war eine Gewichtszunahme assoziiert mit einer geringeren Mortalität. Eine Gewichtszunahme von 4,5 bis 9,0 kg war vorteilhaft für normalgewichtige Patienten, aber es gab keinen Vorteil für die Gewichtszunahme bei zuvor bereits übergewichtigen/adipösen Patienten. Eng korreliert mit einer Gewichtszunahme waren das Gewicht zu Baseline, der CD4-Zell-Status und der Hämoglobin-Gehalt.
In einer Auswertung von 14.084 Patienten aus 17 Kohorten der NA-ACCORD (North America AIDS Cohort Collaboration on Research and Design) wurde im Zeitraum zwischen 1998 und 2010 bereits zu Beginn einer ART eine Zunahme des BMI der Patienten von 1 kg/m2 sowie eine Erhöhung des Anteils adipöser Patienten (BMI ≥30 kg/m2) von 9% auf 18% beobachtet (Koethe et al. 2016). Nach drei Jahren ART hatten 22% der Patienten mit einem zu Baseline normalen BMI (18,5-24,9 kg/m2) ein Übergewicht (BMI 25-29,9 kg/m2) und 18% der zuvor Übergewichtigen eine Adipositas entwickelt.
Einen zunächst ART-unabhängigen Anstieg des Anteils übergewichtiger (von 25% auf 41%) und adipöser (von 3% auf 12%) HIV-Patienten zwischen 1985 und 2004 ermittelten auch Crum-Cianflone et al. (2010) bei 1.682 Patienten der U. S. Military HIV Natural History Study. Prädiktoren für einen höheren BMI waren in dieser Untersuchung eine kürzer zurückliegende HIV-Diagnose, ein höheres Alter der Patienten und ein niedrigeres HIV-Stadium. Unter einer ART mit entsprechend dem Beobachtungszeitraum noch älteren Substanzen (u.a. 71% Zidovudin, 36% Stavudin, 29% Didanosin, 24% Indinavir) nahmen 61,5% der Patienten im Mittel um 7,3 ± 5,9 kg zu.
Eine hohe Prävalenz übergewichtiger und adipöser HIV-Patienten wird inzwischen auch in Ressourcen-armen Ländern in Sub-Sahara Afrika festgestellt. Guehi et al. (2016) fanden unter 755 Teilnehmern einer in der Elfenbeinküste durchgeführten „Early ART-Studie“ (ANRS 12136 Temprano Trial), davon 78% Frauen, einen Anteil von 19,7% übergewichtiger und 7,2% adipöser Patienten. Assoziierte Faktoren für ein hohes Körpergewicht waren weibliches Geschlecht, höheres Lebensalter, gute Lebensbedingungen, eine arterielle Hypertonie und ein niedriges WHO-Stadium der HIV-Infektion. Nach 24-monatiger ART waren sowohl der Anteil der Übergewichtigen als auch der Anteil der Adipösen signifikant auf 24,8% bzw. 9,2% angestiegen.
Risiko für Diabetes
Eine Gewichtszunahme unter ART ist assoziiert mit einem erhöhten Risiko für die Entwicklung eines Diabetes mellitus.
In einer weiteren Analyse der VACS (s.o.) wurden die Prävalenz eines Diabetes mellitus und das Risiko für die Entwicklung eines Diabetes im Falle einer Gewichtszunahme bei HIV-Positiven und einer HIV-negativen Kontrollgruppe verglichen. HIV-positive Patienten hatten zwar eine geringere Prävalenz eines Diabetes (12% vs. 23%), zeigten jedoch pro 2,5 kg Gewichtszunahme ein 14% höheres Risiko für die Entwicklung eines Diabetes im Vergleich zu einem um 8% höheren Risiko in der Gruppe der nicht HIV-Infizierten. Von den Autoren wird deshalb empfohlen, dass HIV-Infizierte nach Beginn einer ART eine substanzielle Gewichtszunahme – mit der Ausnahme einer vorherigen Untergewichtigkeit – vermeiden sollten (Herrin et al. 2016).
Zu einem ähnlichen Ergebnis kommt eine Auswertung der D:A:D-Studie (Achhra et al. 2016).
Ein Anstieg des BMI nach Initiierung einer ART erhöht das Risiko für einen Diabetes mellitus um 11% unabhängig vom Ausgangs-BMI. Dieser stieg innerhalb von 5 Jahren um 2,55 kg/m2 bei zuvor untergewichtigen, um 1,38 kg/m2 bei normalgewichtigen, um 0,73 kg/m2 bei übergewichtigen und um 0,14 kg/m2 bei zuvor bereits adipösen Patienten an. Das Risiko für ein kardiovaskuläres Ereignis stieg im selben Zeitraum um 18%, allerdings nur für zuvor normalgewichtige Patienten. Eine Ursache hierfür blieb unklar. Insgesamt traten 97 kardiovaskuläre Ereignisse sowie 125 Fälle eines Diabetes mellitus neu auf im Verlauf von 43.982 bzw. 43.278 Patientenjahren.
Zunahme unter INI

© zinkevych - fotolia.com
Intergrase-Inhibitoren (INI) in Kombination mit zwei NRTIs werden seit einigen Jahren zunehmend in der antiretroviralen Therapie der HIV-Infektion eingesetzt und in allen relevanten Guidelines (NIH-Guidelines 2017, EACS Guidelines 2017, Deutsch-Österreichische Leitlinien 2017) als initiales Regime empfohlen, in den NIH-Guidelines sogar als einzige Firstline-Option.
Daten zum Gewichtsverlauf im Rahmen einer Initialtherapie mit INI finden sich in nur wenigen Studien, die zudem nahezu ausschließlich andere Parameter als primäre und sekundäre Studienziele untersuchten (Reynes et al. 2013, Clotet et al. 2014, Ofotokun et al. 2015).
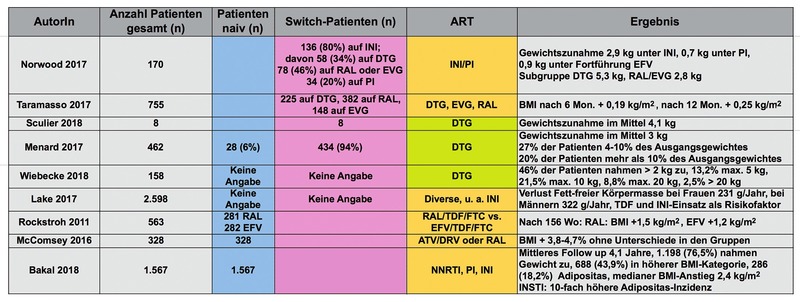
In der STARTMARK-Studie fand sich zu Woche 156 im Raltegravir (RAL)-Arm eine Zunahme des BMI von 1,5 kg/m2 im Vergleich zu einer Zunahme um 1,2 kg/m2 im Efavirenz (EFV)-Arm. Mittels DEXA-Scan wurde eine Fett-Zunahme von 19% unter RAL (n=25) und 31% unter EFV (n=32) gefunden (Rockstroh et al. 2011).
McComsey et al. (2016) untersuchten in einer technisch aufwändigen Studie periphere und zentrale Fett-Depots bei Patienten, die innerhalb der ACTG A5257-Studie (Substudie ACTG A5260s-Studie) neben dem Backbone Tenofovirdisoproxil/Emtricitabin entweder geboostertes Atazanavir (ATV), geboostertes Darunavir (DRV) oder RAL erhalten hatten, zu Woche 96. Hier hatte der Fettanteil sowohl im Bereich der Gliedmaßen als auch abdominell subkutan und viszeral signifikant zugenommen. Der BMI stieg um 3,8% bis 4,7% ohne Unterschied zwischen den verschiedenen Behandlungsgruppen.
Zu deutlich anderen Ergebnissen kam eine Arbeitsgruppe aus Brasilien, die retrospektiv eine Kohorte von 1.794 HIV-Patienten untersuchte, die zwischen 2000 und 2015 eine ART begonnen hatten. 18,3% der Patienten entwickelten im Verlauf eine Adipositas, die Adipositas-Inzidenz betrug 37,4 pro 1.000 Patientenjahre. Größter Risikofaktor für die Entwicklung einer Adipositas war die Primärtherapie mit einem INI. Verglichen mit Patienten, die primär einen PI oder NNRTI erhalten hatten, war die Adipositas-Inzidenz 10-fach erhöht, die jährliche BMI-Zunahme 4-fach größer und die Zeit bis zu einer Adipositas (BMI >30 kg/m2) nahezu halbiert. Weitere Risikofaktoren für eine Adipositas waren ein jüngeres Patientenalter, weibliches Geschlecht, ein hoher BMI zu Baseline, eine niedrige CD4-Zellzahl zu Baseline, eine höhere Baseline-HI-Viruslast, eine Hypertonie und ein Diabetes mellitus (Bakal et al. 2018).
Switch-Studien
Um Substanz-spezifische Ursachen für eine Gewichtszunahme zu untersuchen, sind im Vergleich zu Studien an therapienaiven Patienten Switch-Studien in aller Regel aussagekräftiger, da in der Situation des Regime-Wechsels manifeste AIDS-Erkrankungen, opportunistische Infektionen und ein Wasting mit nachfolgender Immunrekonstitution und Gewichtszunahme eine geringere Rolle spielen.
Norwood und Mitarbeiter (2017) führten eine retrospektive, beobachtende Kohortenstudie durch und werteten die Gewichtsverläufe von insgesamt 495 Patienten aus, die mindestens über 2 Jahre eine stabile ART mit EFV, Tenofovir und Emtricitabin erhalten hatten und dann über die Auswertungsperiode von 18 Monaten entweder auf diesem Regime verblieben (n=325) oder auf ein INI- bzw. PI-basiertes Regime umgestellt worden waren (n=136 bzw. 34).
Die beobachtete Gewichtszunahme war bei Patienten unter INI signifikant stärker ausgeprägt (2,9 kg) als nach Umsetzen auf einen PI (0,7 kg) oder bei Fortführung der NNRTI-Therapie (0,9 kg). Eine Subgruppe mit einem DTG-basierten Regime (n=58) zeigte dabei die höchste Gewichtszunahme (5,3 kg, Patienten mit RAL oder Elvitegravir (EVG) 2,8 kg, n=78).
Auswertungen der italienischen SCOLTA-Kohorte (Surveillance Cohort Long-Term Toxicity Antiretrovirals) ergaben demgegenüber keinen signifikanten Unterschied in der Gewichtsentwicklung bei Patienten, die auf einen INI umgestellt worden waren. In der gesamten Kohorte (n=1.118) nahm der BMI um 0,19 kg/m2 nach 6 Monaten und 0,25 kg/m2 nach 12 Monaten zu, was sowohl für Patienten unter DTG (n=225), als auch unter RAL (n=382), EVG (n=148) und DRV (n=145) signifikant war, nicht allerdings für die Patienten unter Rilpivirin (RPV) (n=218). Es fand sich jedoch kein Unterschied zwischen den Gruppen (Taramasso et al. 2017).
Lake et al. (2017) ermittelten die Einnahme von Tenofovirdisoproxil (TDF) sowie die Einnahme eines INI in einer mehrjährigen DEXA-Scan-Studie bei 839 Frauen und 1.759 Männern als Risikofaktor für einen stärkeren Verlust der fettfreien Körpermasse. Die stärksten Risikofaktoren hierfür waren weibliches Geschlecht, ein Alter >50 Jahre, geringes körperliches Training, Rauchen und eine Viruslast >50 Kopien/ml. Die fettfreie Körpermasse nahm bei Frauen im Mittel um 231 g/Jahr und bei Männern um 322 g/Jahr ab.
DTG-basierte ART
Verschiedene Behandler haben in den vergangenen Jahren bei einigen Patienten unter einer DTG-basierten ART eine z.T. erhebliche Zunahme des Körpergewichtes beobachtet. Diese zunächst rein klinischen Beobachtungen haben bislang zu einigen wenigen retrospektiven und monozentrischen Kohortenanalysen geführt (Menard et al. 2017, Norwood et al. 2017, Wiebecke et al. 2018).
Menard et al. (2017) untersuchten bei 517 Patienten unter DTG-haltiger ART die Ursachen für einen Wechsel dieser Therapie. Bei 55 Patienten (10,6%) war dies wegen Nebenwirkungen notwendig, davon 4 Patienten wegen einer abnormen Gewichtszunahme von 4 bis 12 kg. Daraufhin wurde eine systematische retrospektive Analyse bei den Patienten durchgeführt, die DTG über mindestens 6 Monate erhalten hatten (n=462). Davon waren 28 (6%) therapienaiv, 434 (94%) vorbehandelt. Durchschnittlich stiegen unter Therapie sowohl das Körpergewicht mit 3 kg als auch der BMI mit 1 kg/m2 signifikant an. Bei 27% der Patienten stieg das Körpergewicht um 4-10% an, bei 20% der Patienten um mehr als 20%. Besonders auffällig war die Gewichtszunahme bei Frauen, die mit DTG/Abacavir/Lamivudin behandelt wurden. Bei diesen stieg das Körpergewicht um 5 kg von 57 auf 62 kg an.
In einer Subgruppenanalyse der Studie von Norwood et al. (2017, s.o.) zeigten PatientInnen mit einem DTG-basierten Regime (n=58) eine höhere Gewichtszunahme als PatientInnen unter RAL oder EVG (5,3 kg gegenüber 2,8 kg).
In einer kleinen Untersuchung, die primär die Kontrolle verschiedener HIV-Reservoirs bei DTG-Mono-Erhaltungstherapie (MONODO-Studie) zum Gegenstand hatte, zeigten die Patienten während der 24-wöchigen Therapie eine Gewichtszunahme um durchschnittlich 4,1 kg (Sculier et al. 2018).
Eigene Daten
Im eigenen Patientenkollektiv erhielten zum Zeitpunkt einer retrospektiven Auswertung (Wiebecke et al. 2018) 158 Patienten, 40 Frauen und 118 Männer, eine DTG-haltige ART. Von diesen nahmen insgesamt 73 PatientInnen (46%) mehr als 2 kg Gewicht zu. 21 PatientInnen (13,2%) nahmen 2,1 bis 5 kg zu, 34 PatientInnen (21,5%) 5,1 bis 10 kg, 14 PatientInnen (8,8%) 10,1 bis 20 kg und 4 PatientInnen (2,5%) mehr als 20 kg. Der NRTI-Backbone bestand bei 148 PatientInnen (93,7%) aus Abacavir und Lamivudin, bei 10 PatientInnen aus Tenofovir-Alafenamid (TAF) und Emtricitabin. Die Gewichtszunahme trat überwiegend während der ersten 6 Monate der Therapie auf.
Aktuell (bislang nicht publiziert) finden sich im Kollektiv 25 PatientInnen mit einer Gewichtszunahme >10 kg. Darunter sind 12 zuvor ART-naive Frauen mit einer zu Therapiebeginn mittleren CD4-Zellzahl von 191/µl und einer Ausgangs-Viruslast von im Mittel 271.000 Kopien/ml. Ihre mittlere Gewichtszunahme betrug 18 kg. Bei 13 PatientInnen aus dieser Gruppe war bei einer mittleren CD4-Zellzahl von 812/µl und einer Viruslast durchweg <50 Kopien/ml ein Switch auf DTG erfolgt. Ihre Gewichtszunahme betrug im Durchschnitt 13 kg.
Fazit
Gewichtszunahme und Adipositas mit begleitenden metabolischen und kardiovaskulären Erkrankungen sind ein in den letzten Jahren auch bei HIV-Patienten zunehmend zu beobachtendes Phänomen. Bereits vor Beginn einer ART ist dieser Trend bei neu diagnostizierter HIV-Infektion festzustellen. Dabei spielen allgemeine Entwicklungen in der Bevölkerung, ein höheres Lebensalter bei HIV-Diagnose und ein frühes Infektionsstadium eine Rolle.
Bei zuvor unbehandelten HIV-PatientInnen nimmt unter einer wirksamen ART das Körpergewicht parallel zur Absenkung der HI-Viruslast und einer Immunrekonstitution zu. Dies ist erwünscht und Ausdruck einer klinischen Besserung. Bei nicht wenigen PatientInnen ist diese Gewichtszunahme allerdings besonders ausgeprägt. In Kohortenstudien konnten dafür einige Risikofaktoren identifiziert werden (u.a. weibliches Geschlecht, niedrige Ausgangs-CD4-Zellzahl, hohe Ausgangs-HI-Viruslast). Pathophysiologisch plausible Ursachen für überschießende Gewichtszunahmen konnten bislang allerdings kaum definiert werden.
Es gibt Hinweise, dass bestimmte Substanzgruppen der ART zu einer vermehrten Gewichtszunahme prädisponieren. Dies ist der Fall bei Protease-Inhibitoren, entsprechende Ausführungen finden sich auch den aktuellen Fachinformationen (Prezista®, Reyataz®, Kaletra®). Die bisherigen Daten zur Bedeutung von Integrase-Inhibitoren für die Entwicklung von Übergewicht und Adipositas sind widersprüchlich. Einige Kohorten-Analysen finden eine z.T. enge Assoziation, andere Untersuchungen können dies nicht bestätigen.
Zu Dolutegravir liegen im Hinblick auf eine Gewichtszunahme als eigenständige Nebenwirkung der Substanz bislang lediglich wenige monozentrische Kohortendaten vor. Diese lassen es jedoch möglich erscheinen, dass ein Zusammenhang bestehen könnte. Die Fachinformation von Tivicay® enthält bislang keine Hinweise unter der Rubrik Nebenwirkungen.
Bei einigen Patienten finden sich darüber hinaus ganz außergewöhnlich eklatante Zunahmen des Körpergewichtes, für die es zumindest keine offensichtliche andere Erklärung gibt. Zu der Frage, ob eine unter DTG aufgetretene Gewichtszunahme nach Wechsel der ART reversibel ist, gibt es keinerlei publizierte Erfahrungen.
Die bisherigen Daten rechtfertigen vor dem Hintergrund, dass Übergewicht und Adipositas in Zeiten einer langfristigen Lebensperspektive auch bei HIV-Infizierten einen wichtigen Faktor für Morbidität und Mortalität darstellen, in jedem Fall weitere Aufmerksamkeit und Untersuchungen. Hier wären neben ergänzenden retrospektiven Kohortenanalysen prospektive Studien mit differenzierter Anthropometrie, DEXA-Scan- und Bioimpedanzanalysen sowie Dokumentation metabolischer Parameter wünschenswert.
Daneben besteht unabhängig von Studien die Möglichkeit (und Verpflichtung!), bei entsprechendem klinischen Verdacht einen Bericht über unerwünschte Arzneimittelwirkungen beim BfArM einzureichen und damit auch durch die Dokumentation von Einzelfällen zu mehr Klarheit beizutragen.
Achhra AC, Mocroft A, Reiss P et al. Short-term weight gain after antiretroviral therapy initiation and subsequent risk of cardiovascular disease and diabetes: the D:A:D study. HIV Medicine 2016; 17: 255-268
Bakal DR, Coelho LE, Luz PM et al. Obesity following ART initiation is common and influenced by both traditional and HIV-/ART-specific risk factors. J Antimicrob Chemother 2018; 1-9, doi: 10.1093/jac/dky145
Clotet B, Feinberg J, van Lunzen J et al. Once-daily dolutegravir versus darunavir plus ritonavir in antiretroviral-naive adults with HIV-1 infection (FLAMINGO): 48 week results from the randomised open-label phase 3b study. Lancet 2014; 383: 2222-2231
Crum-Cianflone N, Poehlman Roediger M, Eberly L et al. Increasing rates of obesity among HIV-infected persons during the HIV epidemic. PLoS ONE 2010; 5: e10106
Deutsche AIDS Gesellschaft, Österreichische AIDS Gesellschaft: Deutsch-Österreichische
Leitlinien zur antiretroviralen Therapie der HIV-1-Infektion, Version 7 vom 29.11.2017. https://daignet.de
EACS: Guidelines Version 9.0, October 2017. http://www.eacsociety.org
Fachinformation Prezista® (Darunavir), Stand Juni 2017
Fachinformation Reyataz® (Atazanavir), Stand 02/ 2018
Fachinformation Kaletra® (Lopinavir/r), Stand 08/ 2017
Fachinformation Tivicay® (Dolutegravir), Stand 03/ 2018
Guehi C, Badjé A, gabillard D et al. High prevalence of being overweight and obese HIV-infected persons, before and after 24 months on early ART in the ANRS 12136 Temprano Trial. AIDS Res Ther 2016; 13: 12. DOI 10.1186/s12981-016-0094 y
Herrin M, Tate JP, Akgün KM et al. Weight gain and incident diabetes among HIV-infected veterans initiating antiretroviral therapy compared with uninfected individuals. J Acquir Immune Defic Syndr 2016; 73: 228-236
Koethe JR, Jenkins CA, Lau B et al. Rising obesity prevalence and weight gain among adults starting antiretroviral therapy in the United States and Canada. AIDS RES and Hum Retroviruses 2016; 32: 50-58
Lake J, Erlandson K, Siim M et al. Lean mass declines consistently over 10 years in HIV-infected adults on antiretroviral therapy, with patterns differing by sex. 8th International Workshop on HIV and Aging. October 2-3, 2017. New York
McComsey GA, Moser C, Currier J et al. Body composition changes after initiation of raltegravir or protease inhibitors: ACTG A5260s. Clin Infect Dis 2016; 62: 853-862
Menard A, Meddeb L, Tiissot-Duponnt H et al. Dolutegravir and weight gain: an unexpected bothering side effect? AIDS 2017; 31: 1499-1502
NIH: Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents. https://aidsinfo.nih.gov
Norwood J, Turner M, Bofiill C et al. Weight gain in persons with HIV switched from efavirenz-based to integrase strand transfer inhibitor-based regimens. J AIDS 2017; 76: 527-531
Ofotokun I, Na LH, Landovitz RJ et al. Comparison of the metabolic effects of ritonavir-boosted darunavir or atazanavir versus raltegravir, and the impact of ritonnavir plasma exposure: ACTG 5257. Clin Infect Dis 2015; 60: 1842-1851
Reynes J, Trinh R, Pulido F et al. Lopinavir/ritonavir combined with raltegravir or tenofovir/emtricitabine in antiretroviral-naïve subjects: 96-week results of the PROGRESS study. AIDS Res Hum Retroviruses 2013; 29: 256-265
Rockstroh JK, Lennox JL, Dejesus E et al. Long-term treatment with raltegravir or efavirenz combined with tenofovir/emtricitabine for treatment-naive human deficiency virus-1-infected patients: 156-week results from STARTMARK. Clin Infect Dis 2011; 53: 807-816
Sculier D, Doco-Lecompte T, Yerly S et al. Stable HIV-1 reservoirs on dolutegravir maintenance monotherapy:the MONODO study. HIV Medicine 2018; DOI: 10.1111/hiv.12626
Taramasso L, Ricci E, Menzaghi B et al. Weight gain: a possible side effect of all antiretrovirals. Open Forum Infect Dis 2017; doi: 10.1093/ofid/ofx239
Wiebecke S., Schulze P., Zirkel J. et al. Gewichtszunahme unter Dolutegravir (DTG)-haltiger Therapie (ART)? Kongress für Infektionskrankheiten und Tropenmedizin (KIT), Köln 20.-23.6.2018, P-031
Yuh B, Tate J, Butt AA et al. Weight change after antiretroviral therapy and mortality. Clin Infect Dis 2015; 60: 1852-1859











 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
