International Liver Congress 2019, 10.-14. April 2019, Wien
Hepatitis – der Kampf ist noch nicht zu Ende
Die Hepatitis C-Therapie funktioniert gut. Das belegen neue Analysen, in denen gleich mehrere Kohorten und/oder Studien zusammengefasst wurden. In der größten Metaanalyse mit fast 6.000 Patienten erzielte Glecaprevir/Pibrentasvir eine SVR-Rate von 98,2% (mITT) und zwar unabhängig von Genotyp, Zirrhose, Vorbehandlung, Begleiterkrankung und PPI-Einnahme. 2,4% der Patienten hatten ein virologisches Versagen, allerdings war bei 91/143 Patienten in einer amerikanischen Kohorte „mögliches virologisches Versagen“ angegeben (Cornberg M et al., PS-184). Im deutschen Hepatitis-Register war die SVR bei den rund 1.000 Patienten nach Glecaprevir/Pibrentasvir mit 99,5% (mITT) ähnlich hoch. Es gab sechs Reinfektionen und lediglich fünf Patienten mit virologischem Versagen (Abb. 1) (Cornberg M et al., GS-07). Zu Sofosbuvir/Velpatasvir wurden die Daten von rund 5.500 Patienten ausgewertet. Die SVR lag bei 98,5% (PP). Auch hier hatten alle Subgruppen gleichermaßen gut angesprochen. Virologisches Versagen wurde bei 1,4% der Patienten dokumentiert (Mangia A et al., GS-03).
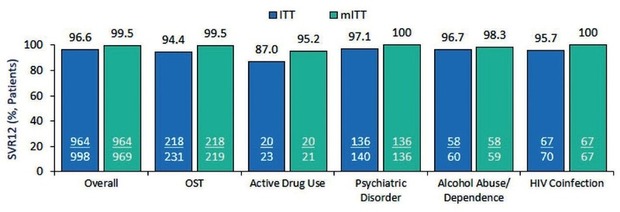
Abb. 1 Deutsches Hepatitis C-Register. SVR-Raten Glecaprevir/Pibrentasvir
Dekompensierte Zirrhose
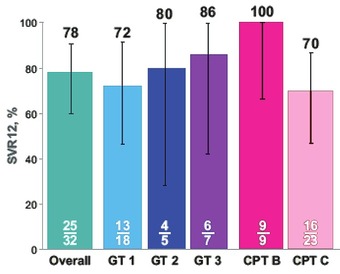
Abb. 2 SVR 12: Insgesamt und nach Unter-gruppe. Intent to Treat
Auch Patienten mit dekompensierter Zirrhose können erfolgreich behandelt werden. Mittel der Wahl ist hier Sofosbuvir/Velpatasvir mit/ohne Ribavirin. In der Studie ASTRAL-4 heilte die Kombination mit Ribavirin 78% der 32 Patienten mit CPT C und ohne NS5A-Vorbehandlung (ITT) (Abb. 2). Nur ein Patient hatte zu Woche 24 einen Relaps mit einer Y93H. Das Nebenwirkungsspektrum entsprach den Erwartungen bei dieser schwer kranken Patientengruppe. Erfreulich war die Verbesserung der Leberfunktion der CPT-Klasse und des MELD-Scores bei 42% bzw. 53% der Teilnehmer (Flamm S et al., THU-138).
Resistenz
Bei
virologischem Versagen unter DAA-Therapie entwickeln sich
Resistenz-assoziierte Mutationen (RAS). NS5A-RAS und
nicht-nukleosidische NS5B-RAS können sehr lange, über 24 Monate
lang, persistieren. Ob man vor Retherapie einen Resistenztest machen
soll, darüber sind sich die Experten nicht einig. Auf der einen
Seite ist es gut zu wissen, wie die Ausgangslage ist, auf der anderen
Seite scheinen diese RAS keinen Einfluss auf das Ergebnis der
Retherapie mit Sofosbuvir/Velpatasvir/Voxilaprevir (SOF/VEL/VOX) zu
haben. Die Triplekombination mit/ohne Ribavirin, die zur Retherapie
nach DAA-Versagen zugelassen ist, heilt nahezu alle Patienten (Tab.
1). Prädiktoren für ein Versagen dieser Retherapie waren männliches
Geschlecht, Zirrhose und Genotyp 1 oder 3. Die Versager waren
vorbehandelt mit Sofosbuvir plus einem NS5A-Hemmer und das
dokumentierte Resistenzprofil war vor und nach
Sofosbuvir/Velpatasvir/Voxilaprevir vergleichbar. Nur zwei Patienten
entwickelten neue Resistenz-assoziierte Mutationen (RAS), einmal eine
Q80K und einmal eine A30K plus Y93H
(Dietz J et al., THU-134 und PS-170).
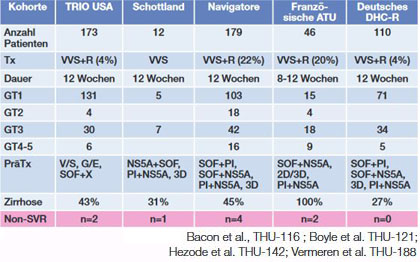
Tab. 1 Re-Therapie mit SOF/VEL/VOX nach DAA Versagen im klinischen Alltag. Nach Sarrazin Christoph, Wiesbaden
Noch kürzer?
Eine Verkürzung der Therapie wird nach wie vor angestrebt. Bei Glecaprevir/Pibrentasvir sind die Daten für acht Wochen bei kompensierter Zirrhose bei allen Genotypen außer GT3 vielversprechend: In einer Metaanalyse von sieben kontrollierten Studien waren die SVR-Raten der Patienten mit und ohne Zirrhose (ohne GT3) bei acht und 12 Wochen mit 99,9% und 100% (mITT) vergleichbar hoch. Nur ein Patient ohne Zirrhose hatte einen Relapse (Zuckerman E et al., TH-198). Bei Therapiebeginn im ersten Jahr nach Infektion könnte die Dauer möglicherweise sogar noch weiter auf sechs Wochen gekürzt werden. In einer Pilotstudie (N=30, 77% HIV-positiv, 87% akute Infektion) wurde nach sechs Wochen Glecaprevir/Pibrentasvir nur ein Relapse beobachtet (Martinello M et al., THU-157). Eine weitere Verkürzung auf vier Wochen in der dänischen Pilotstudie 4RIBC bei GT1 ohne Fibrose war selbst mit Ribavirin nicht von Erfolg gekrönt (Wulf-Madsen L et al., THU-193).
Bei Elbasvir/Grazoprevir hatte in der STAEGER-Studie die Verkürzung bei GT1b F0-2 auf acht Wochen ganz gut funktioniert. In einer taiwanesischen Arbeit war die Verkürzung der konventionellen 12-Wochen-Therapie unterlegen, weil Patienten mit hoher Viruslast (>1,5 Mio IU/ml) und Y93H nur eine SVR von 88% erreichten (Yu et al., THU-195).
Weniger Kontrollen?
Weniger Arztkontakte, weniger Laborkontrollen, das spart Geld und Zeit. In SMART-C wurde dieses Konzept geprüft. Die Patienten hatten nur einen persönlichen Kontakt mit Labor zu Therapiebeginn, zweimal Telefonkontakt und einen letzten Kontakt mit Labor zu Woche 12 nach Therapieende. Im Vergleich zum Standardvorgehen war der Unterschied der SVR-Raten nicht groß (92% vs. 95% ITT), dennoch verfehlte das vereinfachte Protokoll das statistische Ziel der Nicht-Unterlegenheit. Die Autoren sind dennoch guten Mutes und meinen, dass bei Patienten ohne „Adhärenz-Bedenken“ eine Reduktion der Kontakte möglich sei (Dore G et al., PS-178).


Ziel Elimination
Erklärtes Ziel der WHO ist die Elimination der Hepatitis C bis zum Jahr 2030. Island ist diesem Ziel schon sehr nahe. Spanien, Frankreich, Australien und Japan sind auf einem sehr guten Weg. Deutschland wird das Ziel 2030 nicht erreichen, sondern erst Jahre später und auch nur dann, wenn die Bemühungen gesteigert werden. Hier gilt es insbesondere MSM frühzeitig zu behandeln und marginalisierte Gruppen wie aktive, nicht substitutierte Drogengebraucher zu erreichen. Diese Menschen sind meist in einer deutlich schlechteren sozialen Situation als substitutierte Drogengebraucher, die mittlerweile in vielen Studien repräsentiert sind.
Zwei
Arbeitsgruppen behandelten nicht substituierte, aktive
Drogengebraucher in einem niedrigschwelligen „harm
reduction
setting“. Die SVR-Raten waren erfreulich hoch. Probleme gab es bei
Obdachlosen. Hier wurden nur 70% geheilt im Vergleich zu 94% mit
festem Wohnsitz (Thiam A et al., THU-184K). In der zweiten,
spanischen Studie waren Reinfektionen das Problem.
Problem Reinfektion
Die SVR-Rate der mobilen aufsuchenden Einheit war mit 95% (mITT) ebenfalls erfreulich hoch, wertet man jedoch Reinfektion als Versagen, betrug sie nur 80% (ITT). Die Reinfektionsrate der aktiven Drogengebraucher insgesamt lag bei 10/100 Personenjahren (PJ) und war abhängig vom Zeitpunkt der letzten Injektion. Wurden intravenöse Drogen in den letzten sechs Monaten vor Therapiebeginn konsumiert, stieg die Reinfektionsrate auf 17/100 PJ, wurde in den letzten 30 Tagen vor Therapiestart konsumiert, lag sie bei 19/100 PJ. Die mediane Zeit bis zur Reinfektion betrug sieben Monate (Valencia J et al., SAT-216).
Reinfektionen sind auch bei MSM ein Problem. In New York wurde eine Reinfektionsrate von 8,7/100 PJ beobachtet (Fierer D et al., SAT-230). In einer kanadischen Kohorte lag sie mit insgesamt 2/100 PJ deutlich niedriger, wobei junge HIV-positive MSM mehr betroffen (5/100 PJ) und Reinfektionen nach 2005 häufiger waren (Rossi C et al., SAT-216). Bei der Interpretation von Angaben zu Reinfektionsraten ist somit Vorsicht geboten. Studienpopulation, Zeitpunkt und Beobachtungsdauer sind von entscheidender Bedeutung.
Hepatitis B
Der „Aufreger“ bei der Hepatitis B war eine Metaanalyse aus Hong Kong, in der unter Tenofovirdisoproxil (TDF) signifikant weniger hepatozelluläre Karzinome (HCC) beobachtet wurden als unter Entecavir (ETV). Im Lauf von 10 Jahren hatten 1.386/28.041 (7%) Patienten unter ETV sowie 8/1.309 (1%) unter TDF ein HCC entwickelt. Abgesehen von den sehr unterschiedlichen Patientenzahlen waren die Risikofaktoren ungleich verteilt. Die ETV-Patienten hatten mehr Risikofaktoren für ein HCC (z.B. Zirrhose 13% vs. 3%). Dennoch blieb nach rechnerischem Ausgleich der Gruppen ein deutlich niedrigeres HCC-Risiko unter TDF bestehen (Yip TCF et al., LB-03).
Wie schwer es ist, aus solchen Kohortendaten zuverlässige Schlüsse zu ziehen, belegt eine ähnliche Analyse aus den USA, die ebenfalls auf dem Kongress präsentiert wurde. In dieser Analyse war das HCC-Risiko unter TDF ebenfalls geringer. Wurde allerdings nach Ethnie getrennt, hatten Asiaten unter TDF ein um 30% niedrigeres Risiko, während Nicht-Asiaten ein höheres HCC-Risiko hatten (Gordon SC et al., LBP-13).
Therapiepause
Die Therapiepause bei der Hepatitis B hat es mittlerweile bis in die Leitlinien geschafft. Bei HBeAg-negativen Patienten, bei denen mehrere Jahre keine Viren mehr nachweisbar waren, ist ein kontrollierter Absetzversuch eine Option. Nach dem Absetzen sollte man die Entwicklung engmaschig monitorieren. Die Virusdynamik ist sehr variabel und die Aussicht auf einen HBsAg-Verlust gering. Flares werden meist in den ersten 12 Wochen beobachtet (Buti M et al., THU-205). Gefährdet sind hier nach Ergebnissen der STOP-Studie insbesondere Männer, deren HBV-DNA zu Woche 4-6 über 10.000 IU/ml ansteigt (Liem Y et al., FRI-190).
MTCT vermeiden
Ohne Prophylaxe liegt die Transmissionsrate von Mutter auf Kind (MTCT) bei der chronischen Hepatitis B im Durchschnitt bei 29%, wobei es große regionale Unterschiede (Europa 1% Asien 34%) sowie Unterschiede hinsichtlich des HBeAg-Status (HBeAg-positiv 82%, HBeAg-negativ 4%) und der Viruslast (<4 bis 8 log 1-10%) gibt. Durch aktive und passive Impfung des Neugeborenen lässt sich die MTCT-Rate bei HBeAg-negativen Müttern auf 0 senken, bei HBeAg-positiven Müttern immerhin auf 6%. Ein Kaiserschnitt bei hochvirämischen Frauen (VL >6 log IU/ml) senkt das MTCT Risiko ebenfalls hochsignifikant (Jinfeng L et al. FA-01, 03, 05). Sicherlich am besten ist die antivirale Behandlung von hochvirämischen Schwangeren wie es auch die deutsche Leitlinie empfiehlt. Hier ist Tenofovirdisoproxil, das sich auch in der Frühschwangerschaft als sicher erwiesen hat, Mittel der Wahl.
Neue Medikamente
Bei
der Hepatitis B ist man von der Heilung noch weit entfernt, aber es
gibt vielversprechende Ansätze. Am Start stehen Immunmodulatoren,
Capsid-Inhibitoren, iRNAs und am weitesten entwickelt der
Entry-Inhibitor Bulevirtid (Myrcludex B).
Bulevirtid wurde in einer Phase-2-Studie bei Hepatitis Delta geprüft. In Kombination mit pegyliertem Interferon fiel die HDV-RNA innerhalb von 24 Wochen bei vielen Patienten unter die Nachweisgrenze und die GPT normalisierte sich. Gleichzeitig kam es bei 27% der Patienten zum HBsAg-Verlust und bei 20% zur HBsAg-Serokonversion. Die Zulassungsstudien zu dieser Substanz sollen demnächst beginnen (Wedemeyer H et al, GS-13) (Abb. 3).
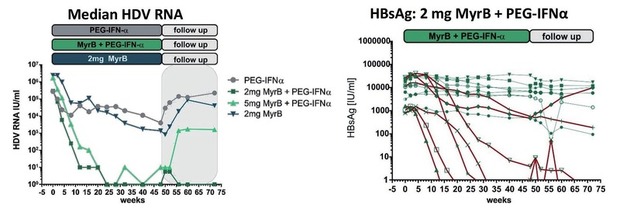
Abb. 3 HBV/HDV-Koinfektion: Myrcludex B mit/ohne PEG-interferon α 2a. Ergebnisse der Phase-2-Studie MYR203
Der Kapsidinhibitor ABI-HO371 führte in Kombination mit einem Nuke wie Entecavir zu einer signifikant stärkeren Senkung der HB-Viruslast als der Polymerasehemmer allein (Ma X et al., LB-06). Das kleine Molekül ccc_R08 senkte in ersten Versuchen nicht nur Viruslast und HBsAg, sondern eliminierte die cccDNA aus Hepatozyten (Gao L et al., PS-074).
Hepatitis E
Die Hepatitis E ist ein wichtiges Thema geworden – zumindest in Universitäten und offenbar in Schottland. Dort ist die Hepatitis E mittlerweile die häufigste virale Hepatitis. Von 2013 bis 2018 wurden 416 Fälle dokumentiert. Betroffen waren meist Männer im Alter von 60 Jahren mit Diabetes, Leberzirrhose oder Transplantation. 62% mussten stationär behandelt werden, 4% verstarben (Wallace S et al., PS-051).
Therapiestandard
ist Ribavirin, was von den meist immungeschwächten Patienten aber
nicht gut vertragen wird.
Sofosbuvir hatte in einer Pilotstudie
des HepNet keinen relevanten antiviralen Effekt, besserte aber die
GPT (Cornberg M et al., LB0-04). Von einer Sofosbuvir-Monotherapie
wird daher abgeraten. Ob Zinksalz bei unzureichendem Ribavirin-Effekt
weiter hilft, ist noch unklar. In einer Studie vom UKE Hamburg hatte
Zink zu in vitro und beim HEV-Infizierten einen dosisabhängigen
antiviralen Effekt (Horvatis T et al., SAT-208YI).
Vorsicht – seltene Genotypen!
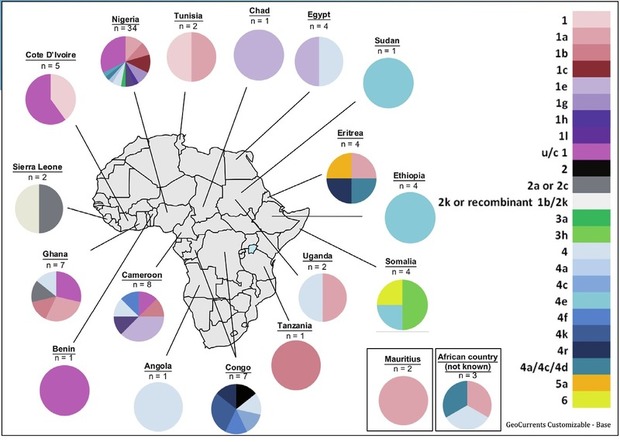
Unerwartet schlechte Ansprechraten wurden bei afrikanischen Patienten in England beobachtet. Die genetische Analyse der Viren löste das Rätsel. Es handelt sich um in Europa seltene Subtypen. Während in Europa vor allem Genotyp 1a und 1b vorkommen, zirkuliert in Afrika ein breites Spektrum anderer Subtypen insbesondere Subtypen von GT1 und GT4. Die SVR-Rate ist allerdings nicht bei allen „exotischen“ Subtypen gleichermaßen erniedrigt. Während bei GT 1 non 1a/non 1b lediglich rund 70% ansprachen, waren es bei GT4 non 4a/4d 100% (Childs E et al., PS-181).











 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
