Martin Däumer, Kaiserslautern
NNRTI aus virologischer Sicht
NNRTI haben seit der Einführung der kombinatorischen ART über lange Zeit eine wesentliche Rolle gespielt. In der ersten Dekade dieses Jahrhunderts enthielt ein Großteil der Initialtherapien 2 NRTI plus einen Erstgenerations-NNRTI, Nevirapin (Viramune®) oder Efavirenz (Sustiva®). Die Zulassung der Fix-dose-Kombination aus Tenofovir DF, Emtricitabin und Efavirenz als Atripla® 2007 markiert den Beginn des Siegeszugs der „Single-Tablet-Regimen“. In der Folge wurden die Zweitgenerations-NNRTI Etravirin (Intelence®, 2008) und Rilpivirin (Edurant®) oder später als Fixdosis-Kombination mit TDF/FTC (Eviplera®2011) oder mit TAF/FTC (Odefsey®) oder in Kombination mit dem Integraseinhibitor Dolutegravir (Juluca®) zugelassen. Beide NNRTI unterscheiden sich hinsichtlich ihrer genetischen Barriere deutlich von den Erstgenerations-NNRTI. Im Falle von Etravirin erfolgte die Zulassung für die Behandlung von ART-erfahrenen Menschen, die mit HIV leben, einschließlich solcher mit vorheriger NNRTI-Exposition.
In der zweiten Dekade dieses Jahrhunderts haben Integraseinhibitoren als Bestandteil der Erstlinientherapie den NNRTI den Rang abgelaufen. Vor diesem Hintergrund ist die Zulassung von Doravirin im Jahr 2019 (Pifeltro® oder als Fix-dose-Kombination mit TDF/FTC Delstrigo®) und die Weiterentwicklung von Rilpivirin als Substanz mit deutlich verlängerter Halbwertszeit („long-acting Formulierung“) als mögliches „Comeback“ dieser Substanzklasse in der breiteren Anwendung zu bewerten.
Überlappendes Resistenzprofil
Alle NNRTI binden an die p66-Untereinheit des HIV-1-Reverse-Transkrip-tase (RT)-Heterodimers in einer hydrophoben Tasche („NNRTI binding pocket“ genannt) in der Nähe des aktiven Zentrums. Diese nicht-kompetitive Bindung induziert eine Konformationsänderung, die das aktive Zentrum der RT in einen inaktiven Zustand überführt.1 NNRTIs sind wirksam gegenüber HIV-1, nicht aber gegenüber HIV-2. So stellt z.B. die bei HIV-1 allseits bekannte Erstgenerations-NNRTI-Mutation K103N bei HIV-2 den Wildtyp dar.
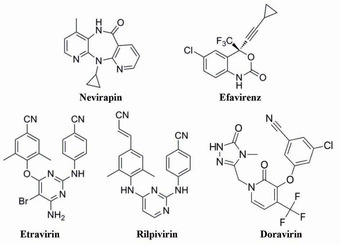
Abb 2 Strukturformeln zugelassener NNRT
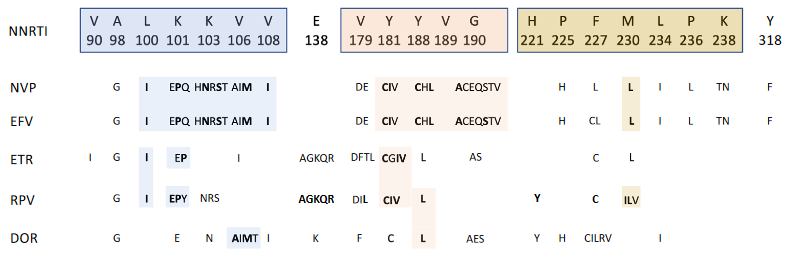
Wie bereits erwähnt, binden alle NNRTI in HIV-1 RT in derselben hydrophoben Tasche. In drei „Clustern“ angeordnet (Aminosäureposition 98-108, 179-190 und 221-238; siehe auch Abb. 1) befinden sich fast alle NNRTI-Resistenz-assoziierte Mutationen innerhalb oder in unmittelbarer Nähe dieser Tasche. Infolgedessen ist die Gefahr überlappender Resistenzprofile zwischen den verschiedenen NNRTI groß. Bei der Entwicklung von „Next Generation“-NNRTI wurde daher besonderes Augenmerk auf die molekulare Flexibilität von Wirkstoffen gelegt („Hufeisenform“ bei ETR, RPV und DOR, s. Abb. 2), die die klassischen NNRTI-Mutationen, wie z.B. die K103N oder Y181C ohne Effektivitätsverlust tolerieren. Im Folgenden werden die oben beschriebenen NNRTIs hinsichtlich ihrer Resistenzprofile erläutert.
Nevirapin (NVP)
NVP von Boehringer-Ingelheim war der erste (1996) von der US-amerikanischen FDA zugelassene NNRTI. Zum Zeitpunkt der Entwicklung war die cART als Behandlungskonzept noch nicht etabliert, sodass NVP zunächst als Monotherapie oder in Kombination mit AZT eingesetzt wurde.2,3 Heute ist es klar, dass der virologische Erfolg nur von kurzer Dauer sein konnte. Und natürlich war das Therapieversagen mit dem Auftreten eines NVP-resistenten Virus verbunden. Die häufigsten Mutationen – die später auch genauso in einer versagenden Kombinations-Therapie auftraten – sind die Mutationen K103N, V106AM, V108I, Y181C, Y188C/L und G190A/S. In Kombination mit AZT oder einem AZT-haltigen Kombipräparat trat interessanterweise die Mutation Y181C selten oder nicht auf. Spätere Untersuchungen zeigten, dass die Y181C-Mutation eine hypersensitivierende bzw. resensitivierende Wirkung (bei bestehenden Thymidin-Analog-Mutationen, TAMs) auf AZT ausübt.4 Sicherlich wurden in einer Zeit begrenzter Behandlungsoptionen derartige Effekte unter Anraten engagierter Virologen genutzt. Heute sollte NVP nicht nur aufgrund der niedrigen Resistenzbarriere nicht mehr in der Initialtherapie eingesetzt werden.
Efavirenz (EFV)
Kein anderer NNRTI wurde weltweit so häufig als „Third Agent“ eingesetzt wie EFV. Einen wesentlichen Beitrag zur Beliebtheit hat sicherlich auch die frühe Verfügbarkeit als STR geleistet. Die Wirksamkeit von EFV wurde in zahlreichen klinischen Studien nachgewiesen. In Nicht-Unterlegenheits-Studien mit Proteaseinhibitoren, Integraseinhibitoren, CCR5-Inhibitoren und anderen NNRTI wurde EFV gerne als Komparator eingesetzt. Als Beispiel sei hier nur die ACTG 5142 erwähnt, in der EFV gegen den Proteaseinhibitor Lopinavir/r antrat.5 Das EFV/NRTI-Regime war dem LPV/r/NRTI-Regime in der Analyse der Zeit bis zum virologischen Versagen signifikant überlegen. Im Falle eines virologischen Versagens musste EFV jedoch eine herbe Schlappe erfahren: 69% der unter dem EFV/NRTI-Regime versagenden Menschen, die mit HIV leben, hatten NNRTI-Mutationen, verglichen mit 0% PI-Mutationen im LPV/r/NRTI-Arm nach 96 Wochen.
Die Mutation K103N ist die bei weitem am häufigsten unter einer EFV-versagenden Therapie auftretende Mutation. Weitere beobachtete Resistenzmutationen umfassen die L100I, K101E, K101Q, V106A/M, V108I, Y188H, Y188L, G190A, G190S und P225H. Hervorzuheben ist, dass die Mutation Y181C in der Regel nicht durch EFV selektioniert wird, was dazu führt, dass in den meisten Resistenz-Algorithmen diese Mutation mit einer eher intermediären Resistenz bewertet wird.
„Überraschend“ für viele war, dass nach dem Ablauf des Patentes für EFV im August 2013 eine Reihe von Publikationen auf neuro-psychiatrische Nebenwirkungen aufmerksam machte [als Beispiel6]. In Analogie zu NVP sollte EFV heute deshalb nicht nur aufgrund der niedrigen Resistenzbarriere nicht mehr in der Initialtherapie eingesetzt werden.
Etravirin (ETR)
Etravirin wurde ursprünglich entwickelt, um EFV- und NVP-resistente Varianten, z.B. mit den Mutationen K103N, Y181C oder G190A, zu inhibieren, was schon auf die Ausrichtung der Zulassung hindeutet.7 ETR ist ein extrem flexibles Molekül, welches sich an die durch die G190A- und Y181C-Mutationen verursachte Konformationsänderung der NNRTI-Bindungstasche gut anpassen kann.8
In den Phase-III-Studien DUET-1 und DUET-2, in denen PI/NNRTI-vorbehandelte Menschen, die mit HIV leben, eingeschlossen wurden, konnten insgesamt 17 ETR-assoziierte Mutationen identifiziert werden: V90I, A98G, L100I, K101E/H/P, V106I, E138A, V179D/F/T, Y181C/I/V, G190A/S und M230L.9 Wichtig zu wissen ist jedoch, dass für ein resistenzbedingtes Therapieversagen in der Regel zwei oder mehr Mutationen erforderlich sind, oftmals unter der Beteiligung der Mutationen L100I, K101P, V179F und Y181I/V.
In Deutschland ist ETR nur in Kombination mit einem geboosterten Protease-Inhibitor plus X für die Behandlung der HIV-1-Infektion zugelassen. Schade eigentlich, denn viele Virologen hätten diese Substanz gerne in Behandlungskonzepten ohne diesen Pferdefuß gesehen.
Rilpivirin (RPV)
Ähnlich
wie bei ETR stand bei der Entwicklung von RPV die Inhibition von
Virusvarianten mit klassischen EFV/NVP-Resistenzen im Vordergrund,
auch wenn die Substanz für vorbehandelte Patienten nicht zugelassen
ist. Aber es gibt ja noch übertragene NNRTI-Resistenzen. In
Zellkultur-Selektionsexperimenten zeigten die häufigsten
Rilpivirin-resistenten Varianten die Mutationen L100I, K101E, V108I,
E138K, V179F, Y181C, H221Y, F227C und M230I.10
In vivo, nämlich in den Zulassungsstudien ECHO und THRIVE, in denen
RPV plus 2 NRTI gegen EFV plus 2 NRTI11,12
verglichen wurde, zeigte sich ein etwas konkreteres Bild: der
überwiegende Teil der resistenz-
bedingten Therapieversagen trat
bei hochvirämischen Patienten auf (>100.000 RNA-Kopien/ml; siehe
auch Zulassung) und war oft auf die Mutation E138K zurückzuführen,
häufig gepaart mit der 3TC/FTC-Mutation M184I/V. Erstaunlicherweise
trägt letztere gerade in dieser Kombination einen nicht
unerheblichen Anteil zur Resistenz gegenüber RPV bei.13
In den Phase-III-Studien ATLAS und FLAIR14, in denen die long-acting Formulierung des RPV mit dem noch nicht zugelassenen Integraseinhibitor Cabotegravir kombiniert wurde, bestätigte sich bei den doch sehr seltenen Resistenz-bedingten Therapieversagen die Bedeutung der E138-Position. Neben der E138K fand sich auch die E138A-Mutation wieder, die als Polymorphismus nicht selten in dem ein oder anderen non-B-Subtyp als Wildtyp vorliegt. Resistenz-Algorithmen wie HIV-GRADE (www.hiv-grade.de) berücksichtigen diese Mutation und bewerten sie als mit intermediärer Resistenz assoziiert.
Doravirin (DOR)
In der Reihe der NNRTI ist DOR bislang die letzte Substanz, die zugelassen wurde. In den Studien DRIVE-FORWARD (Therapienaive; Komparator: geboostetes Darunavir15) und DRIVE-AHEAD (Therapienaive; Komparator: EFV16) wurde bei gerade einmal 7/747 (0,9%!) der Behandelten ein Resistenz-bedingtes Therapieversagen dokumentiert. Das Resistenzprofil unterscheidet sich damit zu einem nicht unerheblichen Anteil von den Kreuzresistenzprofilen der anderen NNRTI (17, siehe Abb. 1). Von zentraler Bedeutung scheinen die Mutationen V106A/M und Y188L zumeist in Kombination mit A98G, H221Y, P225H, F227C oder Y318F zu sein. Die vor kurzem (unter Virologen) noch vielfach diskutierte Mutation V106I, die recht häufig als Polymorphismus bei non-B Subtypen auftritt, scheint jedoch keine Rolle zu spielen.18
Besonders zu erwähnen ist, dass DOR bei NNRTI-resistenten Varianten zumindest mit den Einfachmutationen K103N, Y181C und G190A in vitro voll wirksam ist.19 Auch in der DRIVE-SHIFT Studie (DOR in der Erhaltungstherapie) wurde bei keinem der 24 Patienten mit bereits dokumentierten NNRTI-Mutationen (s.o.) bis Woche 48 ein virologisches Versagen beobachtet.20 DOR darf jedoch laut Zulassung nur in Abwesenheit jeglicher NNRTI-Mutation, also auch der o.g. Mutationen verabreicht werden.
Für die Zukunft könnte die Zweifachkombination Doravirin und Islatravir (nucleosidischer Reverse Transkriptase Translokations Inhibitor, NRTTI) vielversprechend sein. Wenn auch bisher nur mit kleinen Zahlen unterlegt, so scheint diese Kombination hinsichtlich einer Resistenzentwicklung wenig anfällig zu sein.21
Schlussbemerkung
In puncto Resistenz sind wir zugegebenermaßen durch den verstärkten Einsatz moderner Integraseinhibitoren als „Third Agent“ fast schon verwöhnt. Daher müssen sich alle Zweitgenerations- und zukünftigen NNRTI an der Robustheit dieser Substanzen orientieren. Allerdings spielt hier immer noch der Kombinationspartner eine wesentliche Rolle – gerade in Zeiten der wachsenden Beliebtheit von „2 Drug Regimen“.
1 Kohlstaedt, L.A.; Wang, J.; Friedman, et al. Crystal structure at 3.5 A resolution of HIV-1 reverse transcriptase complexed with an inhibitor. Science 1992, 26, 1783-1790.
2 Havlir, D.; McLaughlin, M.M.; Richman, D.D. A pilot study to evaluate the development of resistance to nevirapine in asymptomatic human immunodeficiency virus-infected patients with CD4 cell counts of >500/mm3: AIDS Clinical Trials Group Protocol 208. J. Infect. Dis. 1995, 172, 1379-1383.
3 Richman, D.D., Havlir, D., Corbeil,et al. Nevirapine resistance mutations of human immunodeficiency virus type 1 selected during therapy. J. Virol. 1994, 68, 1660-1666.
4 Larder, B.A. 3‘-Azido-3‘-deoxythymidine resistance suppressed by a mutation conferring human immunodeficiency virus type 1 resistance to nonnucleoside reverse transcriptase inhibitors. Antimicrob. Agents Chemother. 1992, 36, 2664-2669.
5 Riddler SA, Haubrich R, DiRienzo G, et al. A prospec- tive, randomized, Phase III trial of NRTI-, PI-, and NNRTI-sparing regimens for initial treatment of HIV- 1 infection – ACTG 5142. Late Breaker Abstract THLB0204, XVI. International AIDS Conference, 13-18. August 2006, Toronto, Canada
6 Gaida R, Truter I, Grobler C, et al. A review of trials investigating efavirenz-induced neuropsychiatric side effects and the implications. Expert Rev Anti Infect Ther. 2016;14(4):377-88. doi: 10.1586/14787210.2016.1157469.
7 Vingerhoets J, Azijn H, Fransen E, et al. TMC125 displays a high genetic barrier to the development of resistance: evidence from in vitro selection experiments. J Virol. 2005;79(20):12773-12782. doi:10.1128/JVI.79.20.12773-12782.2005.
8 Xu, H., Quan, Y., Brenner, B. G., et al. Human immunodeficiency virus type 1 recombinant reverse transcriptase enzymes containing the G190A and Y181C resistance mutations remain sensitive to etravirine. Antimicrob. Agents Chemother. 2009, 53 (11), 4667-4672.
9 Tambuyzer, L., Vingerhoets, J., Azijn, H., et al. Characterization of genotypic and phenotypic changes in HIV-1-infected patients with virologic failure on an etravirine-containing regimen in the DUET-1 and DUET-2 clinical studies. AIDS Res. Hum. Retroviruses 2010, 26, 1197-1205.
10 Azijn, H., Tirry, I., Vingerhoets, J., et al. TMC278, a next-generation nonnucleoside reverse transcriptase inhibitor (NNRTI), active against wild-type and NNRTI-resistant HIV-1. Antimicrob. Agents Chemother. 2010, 54, 718-727.
11 Rimsky L, Van Eygen V, Hoogstoel A, et al. 96-Week resistance analyses of rilpivirine in treatment-naive, HIV-1-infected adults from the ECHO and THRIVE Phase III trials. Antivir Ther. 2013;18(8):967-77. doi: 10.3851/IMP2636. Epub 2013 May 28. PMID: 23714781.
12 Cohen C, et al. IAS 2011; Rom. #TULBPE032
13 Kulkarni, R., Babaoglu, K., Lansdon, E. B., et al. The HIV-1 reverse transcriptase M184I mutation enhances the E138K-associated resistance to rilpivirine and decreases viral fitness. J. Acquired Immune Defic. Syndr. 2012, 59 (1), 47-54.
14 Overton ET et al. Monthly Long Acting Cabotegravir and is Noninferior to Oral ART as Maintenance Therapy for HIV-1 Infection: Week 48 Pooled Analysis From the Phase 3 ATLAS and FLAIR Studies. IAS 2019, MOPEB 257.
15 Molina JM, Squires K, Sax PE, et al. Doravirine versus ritonavir-boosted darunavir in antiretroviral-naive adults with HIV-1 (DRIVE-FORWARD): 96-week results of a randomised, double-blind, non-inferiority, phase 3 trial. Lancet HIV. 2020 Jan;7(1):e16-e26. doi: 10.1016/S2352-3018(19)30336-4.
16 Orkin C, Squires KE, Molina JM, et al. Doravirine/Lamivudine/Tenofovir Disoproxil Fumarate is Non-inferior to Efavirenz/Emtricitabine/Tenofovir Disoproxil Fumarate in Treatment-naive Adults With Human Immunodeficiency Virus-1 Infection: Week 48 Results of the DRIVE-AHEAD Trial. Clin Infect Dis. 2019 Feb 1;68(4):535-544. doi: 10.1093/cid/ciy540.
17 Hazuda D, Xu M, Ngo W, et al. Understanding the resistance profile of the HIV-1 NNRTI doravirine in combination with the novel NRTTI MK-8591. 22nd International AIDS Conference; 2018; Amsterdam, The Netherlands.
18 Asante-Appiah E, AIDS2020 #PDB0406
19 Feng M, Sachs NA, Xu M, et al. Doravirine suppresses common nonnucleoside reverse transcriptase inhibitor-associated mutants at clinically relevant concentrations. Antimicrob Agents Chemother. 2016 Apr;60(4):2241-2247.
20 Johnson M, Kumar P, Molina JM,et al. Switching to Doravirine/Lamivudine/Tenofovir Disoproxil Fumarate (DOR/3TC/TDF) Maintains HIV-1 Virologic Suppression Through 48 Weeks: Results of the DRIVE-SHIFT Trial. J Acquir Immune Defic Syndr. 2019 Aug 1;81(4):463-472. doi: 10.1097/QAI.0000000000002056.
21 Orkin C et al. Analysis of Protocol-Defined Virologic Failure Through Week 96 From a Phase 2 Trial (P011) of Islatravir and Doravirine in Treatment-Naïve Adults With HIV-1 Infection. HIV Drug Therapy-Glasgow 2020, P047.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
