Ansgar Rieke, Koblenz
HIV und Niere – Teil 1
Die Anzahl der PatientInnen mit HIV >50 Jahre wird bis zum Jahre 2030 auf 73% der zu versorgenden Patienten ansteigen. Mehr als 80% werden relevante Begleiterkrankungen entwickeln: Kardiovaskuläre Erkrankungen, Diabetes mellitus, Bluthochdruck und Tumorerkrankungen werden neben degenerativen Skeletterkrankungen und Nierenerkrankungen die führenden Erkrankungen bei Menschen mit HIV sein. Mit der Zahl der relevanten Begleiterkrankungen wird auch die Begleitmedikation zunehmen. Mit zunehmendem Alter und Komorbidität steigt auch das renale Risiko.
Hohes Alter = vulnerable Niere
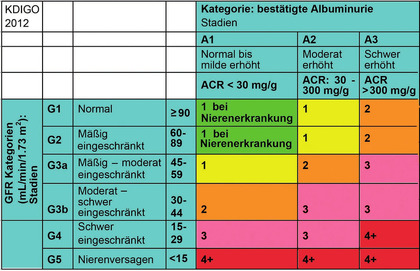
Abb 1 Die Farbskalierung bedeutet die Gefährlichkeit, die Zahl in den Feldern, wie oft die Nierenfunktion / Jahr überprüft werden soll
Alterungsprozesse des Blutgefäßsystems sind aufgrund der intensiven Durchblutung und Filtrationsaufgaben der Nieren von besonders großer Bedeutung. Sie führen zu einer Einschränkung der Nierenfunktion im höheren Lebensalter. In amerikanischen Studien haben ein Drittel der über 70-jährigen PatientInnen eine Nierenfunktionseinschränkung. Höheres Lebensalter bedeutet also erhöhte renale Vulnerabilität. Umso wichtiger ist es, neben der regelmäßigen Bestimmung der zellulären Immunität und Viruslast, Begleiterkrankungen zu berücksichtigen und hier speziell die Niere in den Fokus der Routinekontrollen zu stellen.
Erste Einschätzung
Ganz grob lassen sich die Ursachen von Nierenerkrankungen in prärenale (z.B. Hypovolämie), renale (z.B. Glomerulonephritis) und postrenale (z.B. Aufstau bei Abflusshindernis) Ursachen einteilen. Für die Ersteinschätzung reichen die Anamnese hinsichtlich renaler Risiken (Diabetes, Hochdruck, Hyperlipidämie, Rauchen, Gebrauch von Substanzen (Kokain und NSAR), die Sonographie der Nieren (Nierengröße, Aufstau), Bestimmung der GFR (glomeruläre Filtrationsrate) und das Interesse für den Urin aus. Die Bestimmung der GFR, gleich ob nach Cockroft-Gault, MDRD, Cystatin oder CKD-EPI ist obligat, da das Serumkreatinin (abhängig von der Muskelmasse) kein hinreichendes Kriterium für eine Störung der exkretorischen Nierenfunktion ist. Im Labor sollte Natrium, Kalium, Phosphat, Laktatdehydrogenase, großes Blutbild, Kreatinin und GFR und der Urin zumindest als Stix (Vorsicht Eiweißerfassung nur als Albumin) besser als Spot-Urin erfolgen.
Verkaufskontrolle
Was
für HIV-Spezialisten die CD4-Werte und die Viruslast sind, sind für
die nephrologische Betrachtung die GFR (analog CD4) und das Ausmaß
der Proteinurie (analog VL). Für die Einschätzung des renalen
Risikos
betrachtet man den „GFR-Nadir“ z.B. nach akutem
Nierenversagen (ähnlich wie der CD4-Nadir als schlechtester
Immunstatus) und das Ziel ist es, den Patienten konstant mit der
Proteinurie „unter der Nachweisgrenze“ zu halten. Die Proteinurie
braucht heute nicht mehr im Sammelurin gemessen werden, sondern kann
als Spot-Urin in
der Praxis aus einer einzigen Urinprobe
bestimmt werden. Es wird als UP/C (Protein) oder für Albuminurie als
UA/C in Bezug zur Kreatininausscheidung gesetzt und ist damit valide.
Einteilung Nierenschäden
Von einer chronischen Nierenerkrankung spricht man, wenn über mehr als 3 Monate die GFR auf <60ml/min/ 1,73m2 abgefallen ist oder die GFR um mehr als 5 ml/Jahr über einen Zeitraum von 3 Jahren bzw. um mehr als 25% vom Ausgangswert verringert ist.
Die Albuminausscheidung (UA/C) kennzeichnet glomeruläre Schäden. Die Proteinuriebestimmung mit UP/C erkennt glomeruläre und tubuläre Schäden als Summe, ist also von Vorteil. Eine Proteinurie sollte erst bestätigt sein (Vorsicht Harnwegsinfekt), also kontrolliert werden.
Bei der Proteinurie unterscheidet man grob drei Gruppen: Für UA/C sind dies <30, 30-300 und >300 mg/l und für UP/C <15, 15-50, >50 mg/mmol. UA/C und UP/C-Ratio werden berechnet als Albumin bzw. Protein im Urin (mg/l) / Urinkreatinin (mmol/l). Sie können auch in mg/mg angegeben werden; der Umrechnungsfaktor von mg zu mmol Kreatinin ist x 0,000884.
Analog können auch für die GFR (glomeruläre Filtrationsrate) drei Gefahrenbereiche definiert werden: Es sind >60ml, <60–30 ml und <30 ml/Min. Spätestens unterhalb von 30 ml/Min sollte eine nephrologische Mitbetreuung erfolgen.
Cave ART
Durch die Hemmung des tubulären Kreatinintransporters bei den Substanzen Dolutegravir, Cobicistat, Ritonavir und (geringer) Bictegravir in ART-Kombinationen steigt das Serumkreatinin diskret (ca. 0,14 mg/dl) an bzw. sinkt die eGFR um ca. 10-15 ml ohne dass dies eine Nierenschädigung bedeutet: Die wahre GFR sinkt nicht, nur die abgeschätzte eGFR. Dieser uns bekannte „Cobi-Effekt“ ist mitunter nur schwer zu differenzieren und es hilft nur die Langzeitbetrachtung.
HIV-Glomerulonephritis
Unter
einer HIVAN versteht man einen schnellen Nierenfunktionsverlust, der
besonders bei afroamerikanischen
PatientInnen dunkler Hautfarbe
zu beobachten ist und in wenigen Monaten zur Dialysepflicht führen
kann
(Szczech 2001).
Klinisch imponiert zumeist eine nephrotische Proteinurie mit mehr als
3,5 g/Tag, aber auch
weniger ist möglich. Der Blutdruck ist
normoton oder nur mäßig erhöht, die Nieren sind sonografisch eher
normal groß und sonst unauffällig.
Das
histologische Bild entspricht in etwa 70% einer fokal-segmental
sklerosierenden Glomerulonephritis (FSGN), sowie zystischen tubulären
Veränderungen und Degenerationen. Aber auch andere GN-Formen bis
hin zur Amyloidniere sind unter HIV möglich (Daugas
2005). Fallbeschreibungen
belegten die direkte Infektion der glomerulären Basalmembran mit HIV
und eine beeindruckend positive Wirkung der ART auf die
histologischen Veränderungen (Bruggemann 1997, Winston 2001).
Die
Dysproportionalität des Risikos für eine nichtdiabetische
Nierenfunktionsstörung in dieser Gruppe ist im ApoL1-Gen auf
Chromosom 22 begründet, das für Apoliproprotein L1 (ApoL1) kodiert.
Zwei unterschiedliche Varianten (G1 und G2) davon sind seit 2010
identifiziert, von denen die eine bei Europäern/Kaukasiern praktisch
nicht vorkommt, während die andere bei Menschen schwarzer Hautfarbe
mit einer hypertensiven Nierenkrankheit, einer FSGS und einer HIVAN
assoziiert ist (Sury 2019). Diese genetische Prädisposition führt
wahrscheinlich über die Wechselwirkung des humanen Gens MYH9
(nonmuscle myosin heavy chain 9) mit HIV und dem benachbarten
Apolipoprotein-L1-Gen als Promotor zur HIVAN. Das ApoL1 ist als
Serumfaktor in der Lage, Trypanosoma brucei zu lysieren, sodass über
die relative Immunität gegenüber der Schlafkrankheit ein
evolutionärer Vorteil besteht, jedoch ein Nachteil bezogen auf die
HIVAN, FSGS und hypertensive Nierenerkrankung. Durch diesen
evolutionären Vorteil bei der Schlafkrankheit findet sich die HIVAN
fast ausschließlich bei Menschen schwarzer Hautfarbe (Kao
2008, Kopp 2008,
Soleiman 2011).
In dieser Personengruppe ist die HIVAN die dritthäufigste Ursache für den Beginn einer Dialyse im Alter von 20–64 Jahren. Trotz Hämodialyse beträgt die Ein-Jahres-Mortalität ohne antiretrovirale Therapie (ART) etwa 50%. Die ART hat das Dialyse-Risiko durch HIVAN um 40% reduziert, zudem ist das Ein-Jahres-Überleben unter Dialyse durch ART von 25 auf 75% gestiegen (Winston 2008).
Andere Glomerulon-ephritiden
Bei kaukasischen Patienten sind vor allem die IgA-Nephropathie, die membranöse und die membranoproliferative Glomerulonephritis (GN) mit einer HIV-Infektion assoziiert. Auch ohne typische HIVAN haben PatientInnen mit HIV-Infektion mit 5,6-32% eine deutlich höhere Prävalenz für eine Proteinurie (Soleiman 2011). Neben HIV können weitere Erreger eine postinfektiöse GN oder andere Formen einer chronischen GN auslösen oder unterhalten: Viren wie HBV, HCV, CMV, EBV, VZV sind dazu über eine Reaktivierung bei HIV-Infektion je nach Ausmaß des Immundefektes ebenso in der Lage wie Influenzaviren, Adenoviren, Hantaviren oder Parvovirus B19. Aber auch nach einer Malaria, Lues und Infektionen mit Staphylokokken, Pneumokokken, Legionellen, Salmonellen und anderen Erregern kann eine akute postinfektiöse GN auftreten.
Zusätzlich besteht das Risiko eines zirkulatorischen Nierenversagens bei profusen Diarrhoen im Rahmen einer infektiösen Darmerkrankung, bei Reisediarrhoe oder im Rahmen einer chronischen Diarrhoe durch HIV selbst über den Weg einer mikrobiellen Translokation und Inflammation des Darmepithels oder auch durch opportunistische Erreger wie Krytosporidien.
Membranöse Glomerulonephritis
Bei der membranösen Glomerulonephritis muss als klassische „Sekundär-GN“ gerade unter HIV ein Malignom und eine virale Hepatitis ausgeschlossen werden. Eine chronische Hepatitis C kann meist zur membran-oproliferativen GN oder über eine Kryoglobulinämie zur Vaskulitis mit Nierenbeteiligung führen.
Bei einer postinfektiösen GN und der IgA-Nephropathie wird prinzipiell der zugrunde liegende Infekt behandelt, dies gilt wegen der raschen Progression zur Leberzirrhose besonders für die Hepatitis C und B. Je nach Verlauf sollten dann Nephrologe und Infektiologe gemeinsam eine evtl. zusätzliche Immunsuppression bei HIV unter ART erwägen.
Eine Hepatitis-C-assoziierte GN sollte als extrahepatische Manifestation immer behandelt werden, besonders wenn eine Kryoglobulin-assoziierte Vaskulitis besteht. Dies ist heute mit den pangenotypischen direkt antiviralen Substanzen in allen Stadien einer Niereninsuffizienz möglich.
HUS und TTP
Als Komplikation einer akuten HIV-Infektion und bei unbehandelten HIV-Patienten können thrombotische Mikroangiopathien in Form des hämolytisch-urämischen Syndroms (HUS) bzw. der thrombotisch-thrombozytopenischen Purpura (TTP) auftreten. Klinisch sind diese Erkrankungen durch eine Kombination aus Nierenfunktionsverschlechterung, Zeichen der Hämolyse (Hämoglobin vermindert, Bilirubin erhöht, LDH erhöht, Haptoglobin vermindert, Thrombopenie) und neurologischen Symptomen mit einem Nierenversagen gekennzeichnet. Der Pathomechanismus beruht wahrscheinlich auf der Induktion prokoagulotorischer Effekte des HIV-Oberflächen-Glykoproteins gp120 auf Endothelzellen (Mikulak 2010). In diesen Fällen ist im Falle einer TTP eine Plasmaseparation oder im Falle eines HUS eine Komplementinhibition notwendig. Immer sollte ohne Zeitverzug eine antiretrovirale Therapie begonnen werden. Wegen der raschen Viruslastsenkung und der Einsetzbarkeit bei Niereninsuffizienz empfiehlt sich hier besonders eine Integrasehemmer-basierte ART.
Nephrolithiasis
Antibiotika (Ciprofloxacin, Ampicillin), Aciclovir, Vitamin C, Aspirin, aber auch Proteasehemmer wie (früher) Indinavir, Atazanavir und (eingeschränkt) auch Darunavir können je nach Flüssigkeitsumsatz zu einer vermehrten Kristallurie führen, bei der in Kombination mit anderen Faktoren (z.B. erhöhte Harnsäure) durch Kristallisation eine Nephrolithiasis begünstigt wird. Die früher häufigen Nierensteine unter Indinavir sind erst in Verbindung mit Kalzium röntgendicht, was in der Bildgebung mit einem Kalzium-Oxalat-Stein verwechselt werden kann. Uratsteine sind dagegen röntgentransparent. Mit forcierter Flüssigkeitsgabe, Buscopan und Analgetika lässt sich die Akutsituation einer Nierenkolik meist ambulant behandeln. Sollte eine urologische Vorstellung notwendig sein, müssen Risiken für eine Kontrastmittelgabe mitgeteilt werden.
Interstitielle Nephritis
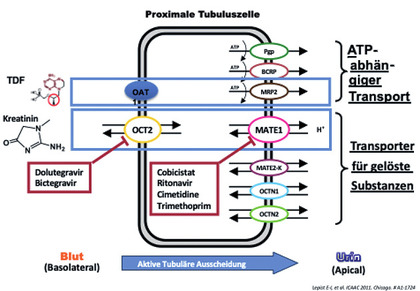
Abb 3 Alternative Kreatininausscheidung über aktive tubuläre Ausscheidung
Verschiedene Medikamente wie NSAR, Indinavir (früher) und Atazanavir können eine interstitielle Nephritis mit Abnahme der eGFR und eine tubuläre Proteinurie hervorrufen. Diagnostische Hinweise können eine Hämaturie und eine Leukozyturie (steril) sein.
TAF und TDF
Bei der Diskussion um den Einsatz von Generika sollte der Unterschied zwischen TDF und TAF an der Niere und das Risiko eines tubulotoxischen Schadens unter TDF beachtet werden. Tenofovir selbst wird neben der glomerulären Filtration tubulär aktiv sezerniert. Bei einer akuten Nierenfunktionsstörung/ANV erfolgt dies verstärkt über eine Hochregulation der Transportsysteme bis zu einer u.U. erhöhten Konzentration von TDF in der Tubuluszelle, die zu einem Rückgang der energieabhängigen Transportkapazität für andere Stoffe führt: Dies zeigt sich als tubulärer Eiweißverlust in den Urin oder unzureichende Glucoserückresorption, Phospatverlust oder Knochendemineralisation.
Das Vollbild ist ein medikamentöses Fanconi-Syndrom mit Glucosurie, Proteinurie (nicht Albumin!) und Hypophosphatämie. Risikofaktoren dafür sind niedriges Gewicht (<60 kg), eine Proteinurie (UP/C >15-50), ein Abfall der GFR um >5 ml/Jahr über drei Jahre bzw. ein Abfall um 25% vom Ausgangswert. TDF sollte nicht mehr zum Einsatz kommen bei einer GFR <60 ml, UP/C >50, nephrotoxischer Begleitmedikation (auch NSAR als Selbstmedikation) bzw. renalen Risiken wie Hochdruck und Diabetes mellitus, hohem Lebensalter oder einer Kombination mit einem geboosterten Proteasehemmer als drittem Partner. Unter TAF wurde nach aktueller Studienlage kein Risiko für tubuläre Störungen gesehen, es darf auch nach einem Fanconi-Syndrom in der Anamnese eingesetzt werden.
Der vermehrte Einsatz von Integraseinhibitoren und die beobachtete Gewichtserhöhung unter TAF-haltigen Kombinationen sollte nicht einseitig die Vorteile von TAF gegenüber TDF an der Niere infrage stellen. Dennoch kann durch Gewichtserhöhung, verschlechterten HOMA-Index und Lifestyle ein Diabetes mellitus oder ein metabolisches Syndrom entstehen, das ein eigenes erhebliches renales Risiko darstellt.
Diabetes mellitus
Mehr als die Hälfte der Patienten mit chronischer Niereninsuffizienz in Deutschland sind durch Diabetes mellitus Dialysepflichtig geworden. Gewichtskontrolle, körperliche Bewegung, eine Anpassung der ART (Lipidprofil), der Versuch einer Lebensstiländerung und Gewichts- sowie Blutdruckkontrolle sind aus renaler Sicht wichtig. Übergewicht für sich allein stellt ein eigenes renales Risiko dar. Immer mehr Daten unterstreichen die Verbindung aus verändertem Mikrobiom und renaler Filtration und werden als „Achse Darm-Niere“ bezeichnet. Zu großer Fleischkonsum oder die Einnahme von Proteinshakes zum Muskelaufbau können eine renale Überforderung sein und sollten einer mediterranen Ernährung Platz machen. Mikrobielle Translokation im Darm bei Immunsuppression, chronische Inflammation, Endotoxine im Blut, sekundäre endotheliale Dysfunktion mit Atherosklerose und erhöhter kardialer und renaler Vulnerabilität sind Diskussionspunkte auf dem Hintergrund von Immundysfunktion und Alter sowie Dauer der HIV-Infektion bei unseren Patienten.
Der Einsatz von Metformin sollte bei Nierenfunktionseinschränkung in niedrigerer Dosis begonnen werden (Vorsicht vor Verstärkung einer Lipatrophie). Sonst spricht vieles für den Einsatz von SGLT-2-Inhibitoren (Dapagliflozin, Empagliflozin, Canagliflocin) zur Blutzuckerkontrolle. Für diese Substanzen ist eine Progressions-hemmung für die diabetische Nephropathie gezeigt worden, Studien bei HIV-PatientInnen fehlen allerdings.
Arterielle Hypertonie
Je
nach Ausmaß kann jede arterielle Hypertonie Ursache einer
Proteinurie sein. Auch andersherum sollte jede Proteinurie Anlass für
eine konsequente Blutdruck-Senkung sein und kann auch eine renale
Funktionsstörung anzeigen. Nach Gesamtsituation und Alter ist das
Stufenschema bei der Therapie zu berücksichtigen. Bei Proteinurie
ist eine Blockade des RAAS (Renin-Angiotensin-Aldosteron-Systems) mit
ACE-Hemmern oder AT1- oder AT2–Inhibitoren sinnvoll und kann eine
Progression einer proteinurischen Nephropathie verzögern. Substanzen
wie Ramipril, Lisinopril, Losartan oder Candesartan müssen auf ihre
renale Verträglichkeit und den Kaliumspiegel im Verlauf überprüft
werden. Je nach Situation kann mit einem Kalzium-Antagonist
(Amlodipin, Diltiazem u.ä.) oder Thiazid-Diuretika kombiniert
werden. Bei fortgeschrittener Niereninsuffizienz (GFR <50 ml/Min)
kann ein Schleifendiuretikum (z.B. Torasemid, Furosemid) eingesetzt
werden. Aus Sicht des
Nephrologen sollte der Blutdruck so tief
wie möglich sein, also bei Nierenfunktionseinschränkung oder
Proteinurie auf Werte um 120/80 mm Hg, sonst immer unter 140/95 mm Hg
eingestellt werden. Die Wechselwirkungen mit der ART sind dabei zu
beachten.
Chronische Nierenkrankheit
Der
Verlust an glomerulärer Filtration durch die Reduktion
funktionsfähiger Nephrone im Laufe des Lebens kennzeichnet das
biologische Altern: Von gesund etwa 90-120 ml/Min kommt es zu einem
Verlust der GFR von etwa
1 ml/Jahr und Akzentuierung ab dem 40.
Lebensjahr mit etwa 10-15 ml/Dekade. Belastungsfaktoren wie Rauchen,
Hochdruck, Diabetes, Übergewicht, aber auch Ernährung, Bewegung und
Umwelteinflüsse (auch Feinstaub) beschleunigen oder verlangsamen
diesen Prozess. Es gilt, die individuellen Faktoren des Patienten
neben der guten Einstellung seiner HIV-Infektion zu erkennen und
individuell zu optimieren, sofern und solange dies möglich ist.
Viele Systeme entgleisen
Bei einer Verschlechterung der Nierenfunktion geraten eine Vielzahl von Systemen aus dem Gleichgewicht und bedürfen einer therapeutischen Intervention: Das Ausmaß der GFR-Reduktion sowie das der Proteinurie korrelieren direkt mit dem kardiovaskulären Risikoprofil und sollten sorgfältig wahrgenommen werden. Über eine fast regelhafte arterielle Hypertonie, eine KHK, Zunahme der linksventrikulären Masse, Fettstoffwechselstörung entsteht im Rahmen der Niereninsuffizienz eine renale Anämie durch Mangel an Erythropoetin und Knochenmarktoxische Stoffwechselakkumulationen bei schleichender Urämie. Eine renale Azidose muss korrigiert werden, ein sekundärer Hyperarathyreoidismus führt zur Dysbalance von Phosphat, Kalzium, Vitamin-D-Haushalt und Knochenstoffwechsel bis hin zur renalen Osteopathie und begünstigt eine rasch fortschreitende Atherosklerose und Herzklappenverkalkung – wenn nicht rechtzeitig gegengesteuert wird.
Veränderungen des Salzhaushaltes, Flüssigkeitsbelastung, Ödemneigung, Elektrolytdysbalance, Eiweißverlust bei nephrotischem Syndrom und Gefäßänderungen sind als komplexe Systemstörungen aufzufassen und erfordern eine spezialisierte Einstellung durch den Nephrologen. Fast regelhaft besteht im Rahmen einer fortgeschrittenen Nierenkrankheit eine eigenständige Immundysfunktion mit Infektanfälligkeit zusätzlich zu der HIV–Infektion. So verwundert es nicht, wenn die Prognose eines/r PatientIn mit chronischer Nierenkrankheit schlechter ist als bei mancher Tumorerkrankung.











 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
