Christian Hoffmann, Hamburg
Zwei neue Optionen bei „HTE“-Patienten
Auch bei intensiv vorbehandelten HIV-PatientInnen (im HIV-Jargon scheint sich neuerdings „HTE“ zu verbreiten = „heavily treatment experienced“) sollte immer versucht werden, die Viruslast unter die Nachweisgrenze zu senken. Die Gründe liegen auf der Hand: Verhindert werden soll nicht nur die Transmission multiresistenter Stämme, sondern auch AIDS-Erkrankungen bei den Betroffenen. Diese haben nämlich eine ungünstigere Prognose – vor allem, wenn die Viruslast nicht gesenkt werden kann. So war das AIDS-Risiko in der italienischen PRESTIGIO-Kohorte (148 Fälle einer Vierklassen-Resistenz) bei Virämie deutlich erhöht (Galli 2020).
Ibalizumab (Trogarzo®)
Ibalizumab
ist ein monoklonaler Antikörper, der direkt an den CD4-Rezeptor
bindet und so den Eintritt von HIV verhindert. Im Gegensatz zu
anderen Attachment-Inhibitoren scheint Ibalizumab nicht die Bindung
von gp120 an CD4 zu verhindern, sondern eher die anschließende
konformationelle Änderung und damit die Bindung von gp120 an CCR5
und CXCR4. Diese Post-Attachment-Inhibition ist ein neuer
Wirkmechanismus, Kreuzresistenzen sind nicht zu erwarten. Eine Frage
ist, ob die Funktionalität der CD4-Zellen beeinträchtigt wird.
Angeblich ist die Bindungsstelle von Ibalizumab an CD4 anders
lokalisiert als die Bindungsstellen der natürlichen CD4-Liganden,
den HLA-Klasse-II-Molekülen. Die CD4-
Zellen sollten daher ihre
normalen Funktionen wahrnehmen können.
Mittlerweile liegen mehrere – allerdings bemerkenswert kleine - Phase II/III-Studien vor, in denen sich unter Monotherapie innerhalb weniger Tage ein Abfall der Viruslast von etwa einer Logstufe zeigte (Khanlou 2011, Emu 2018, Gathe 2020). Ein antiretroviraler Effekt war zumindest teilweise auch nach 6-12 Monaten noch zu sehen. Die Verträglichkeit scheint gut zu sein, allerdings fehlen gerade über längere Zeiträume die Erfahrungen. Hauptproblem ist die umständliche Applikationsart. Ibalizumab ist als intravenöse Infusion über 30 Minuten zu verabreichen, eine Gabe als Bolusinjektion ist nicht möglich. Die empfohlene Dosis besteht aus einer Aufsättigung mit 2.000 mg, gefolgt von einer Erhaltungsdosis von 800 mg alle zwei Wochen. Längere Intervalle sind nicht möglich, da der Antikörper eine relativ kurze Halbwertzeit hat. Wenn eine Erhaltungsdosis um drei Tage oder länger versäumt wird, ist eine erneute Aufsättigung erforderlich.
Ibalizumab
wird nur für sehr wenige ausgewählte Fälle in Frage kommen. Eine
Umfrage unter 56 deutschen HIV-Zentren ergab 2018 einen Bedarf für
Ibalizumab für etwa 25 PatientInnen. In der LOWER-Studie, in der
etwa 25% aller PatientInnen mit Multiresistenz
in Deutschland untersucht wurden, waren lediglich 7 von
243 Patienten virämisch und ohne weitere Optionen. In der Schweizer
Kohorte wurden gerade einmal 14 Fälle einer Vierklassen-
Resistenz
gesehen (Scherrer 2016). Es ist also zu erwarten, dass die Fallzahl
in Deutschland deutlich unter 100 liegen dürfte. Für diese wenigen
Fälle dürfte Ibalizumab allerdings eine lebensrettende neue Option
sein.
Relevant ist der Preis von Ibalizumab: Er bewegt sich (noch) im sechsstelligen Bereich pro Jahr. Fast erwartbar sah der GBA in seinem Beschluss vom 18. Februar 2021 einen Zusatznutzen als „nicht belegt“ und befand gewohnt trocken: „Es wurden keine für die Nutzenbewertung geeigneten Daten vorgelegt.“ Preisverhandlungen laufen, mit einigen Kassen gibt es wohl schon Rabattverträge.
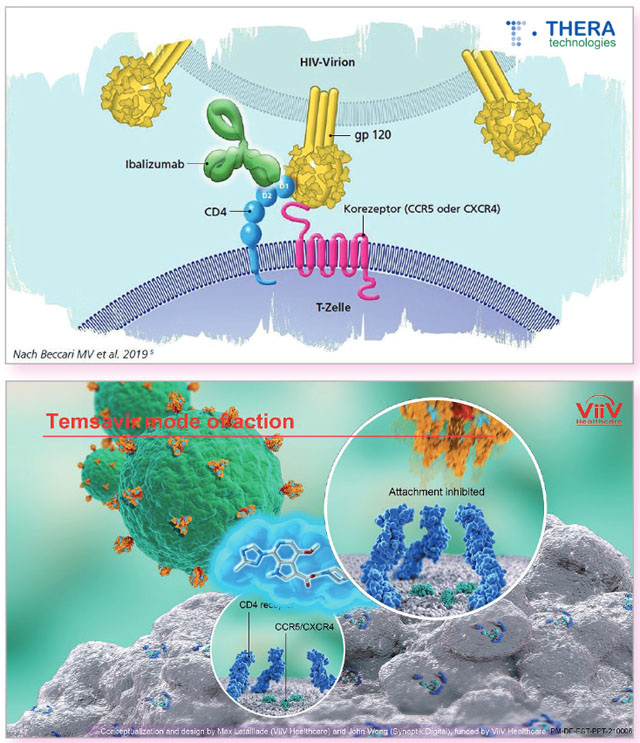
Wirkmechanismus des Post-Attachment-Inhibitors Ibalizumab (oben) und des Attachment-Inhibitors Temsavir (unten)
Fostemsavir (Rukobia®)
Fostemsavir (GSK3684934, früher BMS-663068) ist ein Prodrug des Attachment-Inhibitors Temsavir. Ursprünglich von BMS entwickelt und mittlerweile von ViiV Healthcare übernommen, bindet Temsavir als „small molecule“ reversibel an gp120 und verhindert eine Konformationsänderung, die für das Andocken an die CD4-Zelle notwendig ist. Temsavir bindet also nicht wie Ibalizumab an den CD4-Rezeptor, sondern an das Virus selbst. Weiterer Unterschied: Anders als Ibalizumab kann es oral verabreicht werden. Die 600 mg-Tablette muss zweimal täglich eingenommen werden. Die Wirkung erstreckt sich über R5- und X4-trope Viren.
Unter Monotherapie sank die Viruslast innerhalb weniger Tage um immerhin 1,2-1,8 Logstufen (Nettles 2012), in einer noch von BMS initiierten Studie war der antivirale Effekt in etwa mit dem von Atazanavir/r vergleichbar (Thompson 2017). Mittlerweile liegen 96-Wochen-Daten einer großen Phase-III-Studie (BRIGHTE) vor, in der 371 vorbehandelte PatientInnen mit Therapieversagen mit Fostemsavir und einer optimierten Hintergrund-ART behandelt wurden (Lataillade 2020). Insgesamt 168 Zentren waren nötig, um die notwendige Fallzahl zusammen zu bekommen. Die PatientInnen waren intensiv vorbehandelt, 80% hatten vorherige INSTI-, über 90% PI-Erfahrungen. Weniger als die Hälfte hatte noch mehr als eine aktive Substanz. Nach zwei Jahren hatten immerhin 60% eine Viruslast unter 40 Kopien/ml erreicht, in der Subgruppe der Patienten ohne jede weitere Option waren es immerhin noch 37%. Die Ansprechraten waren vor allem von der Zahl der noch aktiven Substanzen in der Begleit-ART abhängig (Ackerman 2021).
Die Verträglichkeit war insgesamt gut, die Nebenwirkungen überstiegen selten Grad 1 (vorwiegend gastrointestinaler Art) und führten noch seltener zum Abbruch. Da Fostemsavir diverse Transporter-Proteine (u.a. für Statine) hemmt, ist allerdings mit Interaktionen zu rechnen, Dosisanpassungen werden ggf. erforderlich sein. Ein weiteres Problem könnten Resistenzen sein. Die Bindungsstelle von gp120 ist eine der variabelsten Stellen von HIV überhaupt. Andererseits spricht der anhaltende Erfolg der BRIGHTE-Studie eher gegen eine rasche Resistenzentwicklung.
Fostemsavir ist damit eine wichtige Option für intensiv vorbehandelte Patienten. Im Februar 2021 wurde die Zulassung in Europa erteilt. Mit einer Nutzenbewertung wird für Anfang Juli gerechnet, mit einem Beschluss des GBA für September. Der Preis für Rukobia® wird in etwa dem Vierfachen eines der gängigen STRs entsprechen – der Hersteller wird sich den möglichen Zusatznutzen (der angesichts der umfangreicheren Datenlage wahrscheinlich ist als für Fostemsavir) bezahlen lassen.
Offene Fragen
Für beide Präparate bleiben noch viele Fragen offen, nicht nur zur Langzeitbehandlung und zur Resistenzentwicklung, sondern insbesondere auch zur Kombination – und zwar nicht nur untereinander, sondern auch mit den weiteren spannenden Optionen, die sich bereits am Horizont abzeichnen, darunter vor allem der RT-Transloka-tionsinhibitor Islatravir von MSD und der Kapsid-Inhibitor Lenacapavir von Gilead (zu beiden mehr in der kommenden Ausgabe).
Ackerman P, Thompson M, Molina JM, et al. Long-term efficacy and safety of fostemsavir among subgroups of heavily treatment-experienced adults with HIV-1. AIDS. 2021 Jun 1;35(7):1061-1072.
Emu B, Fessel J, Schrader S, et al. Phase 3 Study of Ibalizumab for Multidrug-Resistant HIV-1. N Engl J Med 2018, 379:645-654.
Galli L, Parisi MR, Poli A, et al. Burden of Disease in PWH Harboring a Multidrug-Resistant Virus: Data From the PRESTIGIO Registry. Open Forum Infect Dis. 2020 Sep 26;7(11):ofaa456.
Gathe JC, Hardwicke RL, Garcia F, Weinheimer S, Lewis ST, Cash RB. Efficacy, Pharmacokinetics, and Safety Over 48 Weeks With Ibalizumab-Based Therapy in Treatment-Experienced Adults Infected With HIV-1: A Phase 2a Study. J Acquir Immune Defic Syndr. 2021 Apr 1;86(4):482-489.
Khanlou H, Gathe G, Schrader S, et al. Safety, efficacy, and pharmacokinetics of ibalizumab in treatment-experienced HIV-1 infected patients: A phase 2b study. Abstract H2-794b, ICAAC 2011. Chicago.
Lataillade M, Lalezari JP, Kozal M, et al. Safety and efficacy of the HIV-1 attachment inhibitor prodrug fostemsavir in heavily treatment-experienced individuals: week 96 results of the phase 3 BRIGHTE study. Lancet HIV. 2020 Nov;7(11):e740-e751. PubMed: https://pubmed.gov/33128903. Full-text: https://doi.org/10.1016/S2352-3018(20)30240-X.
Nettles RE, Schürmann D, Zhu L, et al. Pharmacodynamics, safety, and pharmacokinetics of BMS-663068, an oral HIV-1 attachment inhibitor in HIV-1-infected subjects. J Infect Dis 2012, 206:1002-11.
Scherrer AU, von Wyl V, Yang WL, et al. Emergence of Acquired HIV-1 Drug Resistance Almost Stopped in Switzerland: A 15-Year Prospective Cohort Analysis. Clin Infect Dis 2016, 62:1310-17.
Thompson M, Lalezari JP, Kaplan R, et al. Safety and efficacy of the HIV-1 attachment inhibitor prodrug fostemsavir in antiretroviral-experienced subjects: week 48 analysis of AI438011, a Phase IIb, randomized controlled trial. Antivir Ther 2017, 22:215-223.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
