PD DR. CHRISTIAN HOFFMANN, HAMBURG
Neu im EAP: NNRTI Etravirin
Für NNRTIs ist es ein steiniger Weg zur Zulassung. Seit Efavirenz 1998 hat es kein NNRTI mehr auf den Markt geschafft, obwohl angesichts zunehmender Resistenzen dringend Bedarf bestünde. Und zwar nicht nur für vorbehandelte Patienten. 2002 wurden bei fast 10% aller Patienten in Europa mit akuter HIV-Infektion NNRTI-Resis-tenzen detektiert (Wensing 2005). Etravirin (ehemals TMC 125) ist der derzeit am weitesten entwickelte neue NNRTI.
Als Diarylpyrimidin-(DAPY)-Analogon besitzt Etravirin eine gute Wirksamkeit gegen Wildtypviren und gegen resistente Mutanten, vor allem gegen klassische NNRTI-Mutationen wie K103N. Die Resistenz-Barriere liegt offensichtlich höher als für andere NNRTIs, da Etravirin als DAPY-Analogon durch Konformationsänderungen flexibel an die Reverse Trans-kriptase von HIV-1 binden kann (Vingerhoets 2005). Mutationen an der Bindungsstelle des Enzyms können so der Bindung und damit der Wirkung dieses NNRTIs weniger etwas anhaben (Das 2004).
BEACHTLICHE POTENZ
In Phase I/II-Studien senkte Etravirin die Viruslast bei therapienaiven HIV-Patienten um beachtliche 2,0 Logstufen nach einer Woche (Gruzdev 2003), bei NNRTI-Mutationen waren es noch 0,9 Logstufen (Gazzard 2003, Sankatsing 2003). In C233, einer Phase II-Studie an 199 vorbehandelten Patienten mit NNRTI- und PI-Mutationen, lag die Viruslast nach 48 Wochen signifikant niedriger als unter Plazebo (Abb. 1) (Cohen 2006). Allerdings nahm die Wirkung mit zunehmenden NNRTI-Resistenzen ab. Bei einer Mutation waren es 1,38, bei mehr als zwei nur noch 0,54 Logstufen (Abb. 2). Y181C zusammen mit Mutationen an den Codons 101, 179, 190, und 230 erhöhten in vitro die Resistenz gegenüber Etravirin (Vingerhoets 2006).
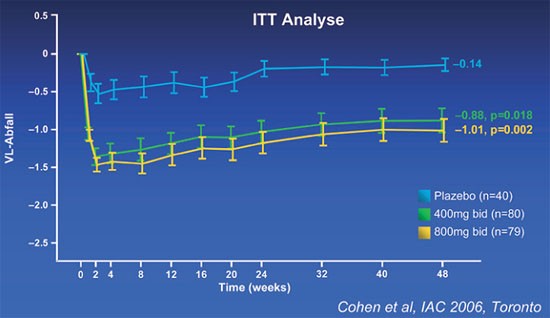
Abb. 1: Abfall der Viruslast unter Etravirin. Phase II. Woche 48
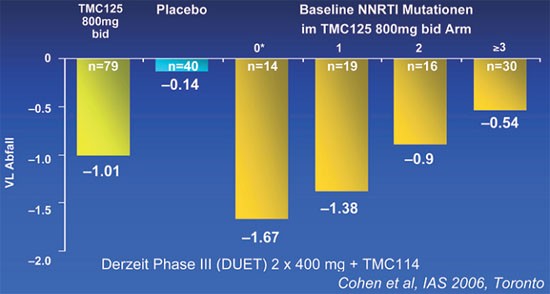
Abb. 2: Abfall der Viruslast unter Etravirin in Abhängigkeit
von der Zahl der NNRTI-Mutationen zu Baseline. Phase II. Woche 48
Eine weitere Phase II-Studie brachte einen ersten Rückschlag für die Substanz. In dieser Studie wurde Etravirin gegen einen vom Behandler ausgewählten Proteasehemmer bei insgesamt 116 Patienten verglichen, die ein NNRTI-Versagen erlitten hatten. Die Studie musste vorzeitig abgebrochen werden, da Etravirin dem Proteasehemmer-Arm signifikant unterlegen war (Woodfall 2006). Von Seiten des Herstellers wurde argumentiert, dass die Baseline-Resistenzen in dieser in Thailand und Südafrika durchgeführten Studie, in denen die Patienten teilweise sehr lange mit NNRTIs vorbehandelt gewesen waren, zahlreicher als erwartet gewesen wären.
DUET: ETRAVIRIN UND DARUNAVIR
Derzeit wird Etravirin in zwei großen Phase III-Studien (DUET-1 und -2) zusammen mit dem unlängst zugelassenen Proteasehemmer Darunavir (Prezista®) untersucht. Die beiden Studien, deren erste Resultate im Sommer auf der Konferenz in Sydney vorgestellt werden, dürften den wahren Wert der Substanz offenbaren. Zudem wird aktuell an verbesserten Formulierungen gearbeitet, um die Pillenzahl zu reduzieren.
NEBENWIRKUNGSPROFIL
Vertragen wurde Etravirin in den bisherigen Studien durchweg gut, es ist allerdings mit Efavirenz- bzw. NNRTI-typischen Problemen (Schwindel, Ausschlag) zu rechnen. In der C233-Studie entwickelten immerhin 20% einen Hautausschlag, einige Patienten mussten Etravirin abbrechen. Obwohl der Rash in den meisten Fällen mild ist, ist wie bei allen anderen NNRTIs Wachsamkeit geboten. Gleiches gilt für Leberwerterhöhungen. Relevante Interaktionen mit antiretroviralen Medikamenten scheint es wohl eher nicht zu geben, mit einer Ausnahme. Wird Etravirin mit Tipranavir kombiniert, sinken die Etravirin-Spiegel signifikant (Kakuda 2006).
EAP ANGELAUFEN
Ein Expanded-Access-Programm ist in Deutschland im Februar 2007 angelaufen. Es bietet den Zugang zu Etravirin für Patienten älter sind als 18 Jahre und limitierte Behandlungsalternativen haben. Weitere Einschlusskriterien sind u.a. eine Vorbehandlung mit mindestens drei Substanzklassen (mindestens 2 PIs, NRTI, NNRTI) oder zwei Klassen (PI, NRTI) bei einer primären NNRTI-Resistenz sowie "aktuell keine virologische Suppression", ohne dass hierbei ein Grenzwert festgelegt wäre. Die im EAP-Programm vorgesehene Dosis ist 2x 200 mg (2x 2 Tabletten zu 100 mg), die jeweils zu den Mahlzeiten eingenommen werden sollen. Geplant ist das Programm bis zur voraussichtlichen Marktzulassung 2008.
Priv.-Doz. Dr. med. Christian Hoffmann
ifi Institut, AK St. Georg
Haus K, Lohmuehlenstr. 5 · 20099 Hamburg
Tel 040 181885 3780 · Fax 040 181885 3788
hoffmann@ifi-medizin.de
Literatur beim Verfasser










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
