
3. INTERN. WORKSHOP ZU HIV- UND HEPATITIS-KOINFEKTION 7.-9.06.2007, PARIS
Koinfektionen schwierig zu behandeln
Zum dritten Mal trafen sich in Paris Spezialisten auf dem Gebiet der Hepatitis-Koinfektion bei HIV-positiven Patienten. Rund 300 Teilnehmer waren aus Europa und Amerika angereist. In dem drei Tage umfassenden Programm wurden sämtliche wichtigen Aspekte der Hepatitis-Koinfektion abgehandelt.
Bei der Entwicklung neuer HCV- (Hepatitis C-Virus)-spezifischer Medikamente wie HCV-Protease- und Polymerasehemmern sind Resistenzen und damit das "genetische Verhalten" des Virus von entscheidender Bedeutung. Im Vergleich zu HIV oder HBV ist die genetische Variabilität des HCV-Genoms wesentlich größer. Das HCV-Genom verändert sich nämlich im natürlichen Verlauf schneller und weitreichender. Kurz aufeinander folgende genetische HCV-Analysen bei Patienten mit frischer HCV-Infektion zeigen bereits nach einem Monat eine erhebliche Diversifikation des Genoms. Bei Patienten mit langjähriger chronischer Hepatitis C wurden weitere genetische Diversifikationen bis hin zu zwei völlig unterschiedlichen Subspezies beobachtet. Veränderungen von einem Genotyp zu einem anderen sind nach heutigem Wissenstand jedoch nicht möglich (Stuart Ray, John Hopkins Universität in Baltimore).
HCV-RESISTENZ
Das HCV-Genom unterliegt ähnlich wie HIV den Einflüssen von Wirtsfaktoren, z.B. einem wirtsspezifischen Selektionsdruck durch das HLA-System. Diese Anpassungsfähigkeit von HCV kann zu Interaktionen mit der HCV-Polymerase und Proteasehemmern führen. Bedeutsam für die zukünftige Therapie und Resistenzentwicklung sind womöglich auch die erst vor kurzem nachgewiesenen rekombinanten HCV-Varianten. Die Rekombination kann die Diagnose des HCV-Genotyps erschweren und das Virus könnte durch den Austausch großer Genabschnitte mehrere Schritte in der Resistenzentwicklung überspringen. Insgesamt gibt es somit derzeit wenig Hoffnung, dass HCV mit Polymerase und Protease-Hemmern leichter behandelbar sein sollte als HIV (Ray S invited lecture).
GBV-C VIRUS
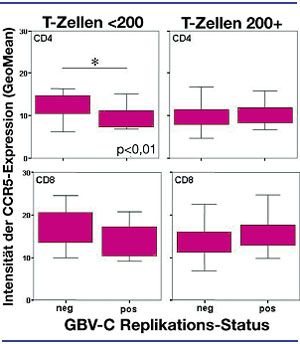
Abb. 1: CCR5-expres-sion nach GBV-C Virämie und CD4-Zellzahl: GBV-C positive Patienten mit einer
CD4-Zellzahl unter 200/µl exprimierten signifikant seltener CCR5 an der Zelloberfläche
CD4-positiver T-Zellen als GBV-C negative Patienten. Bei Patienten mit einer CD4- Zellzahl über 200/µl
waren diese Unterschiede nicht mehr sichtbar. Unabhängig vom CD4-Zellstatus zeigte sich kein Effekt
in der Exprimierung von CCR5 auf CD8-positiven Zellen.
HIV-positive Patienten mit gleichzeitiger GBV-C-Infektion scheinen einen besseren natürlichen Verlauf der HIV-Infektion zu haben als GBV-C-negative Patienten. Dieser Effekt wurde nicht in allen Kohorten-Analysen nachgewiesen, war aber in Kohorten mit sehr niedrigen CD4-Helferzellen besonders ausgeprägt. Der zugrunde liegende Mechanismus ist bislang unklar. Möglicherweise hat die GBV-C-Infektion einen Einfluss auf die Expression von CCR5- und CXCR4-Rezeptoren auf CD4- und CD8-positiven T-Zellen. In einer Analyse der Köln-Bonner Kohorte, die Carolin Schwarze-Zander, Bonn, präsentierte, lag bei 30% aller HIV-infizierten Patienten eine GBV-C-Replikation vor. Die GBV-C-Virämie war mit einer verminderten Expression von CCR5- und CXCR4-Rezeptoren auf den CD4-Helferzellen assoziiert und zwar insbesondere bei Patienten mit einer Helferzellzahl <200/µl (Abb. 1). Dies könnte erklären, warum der protektive Effekt einer GBV-C-Infektion vor allem für Patienten in fortgeschrittenen HIV-Stadien beschrieben ist (Schwarze-Zander et al. #2).
HCV-GENOTYP 4
HCV-Genotyp 4 und -Genotyp 1 gelten gleichermaßen als schlecht behandelbar. Tatsächlich gibt es aber nur wenig Daten zur Therapie des seltenen Genotyp 4. Martin-Carbonero von der Universität Madrid stellte eine gepoolte Analyse zweier multizentrischer Studien, der PRESCO- und ROMANCE-Studie, vor. Erfasst wurden 75 Patienten mit HIV/HCV-Koinfektion Genotyp 4 (medianes Alter 40 Jahre). Die CD4-Zellzahl bei Therapiebeginn lag bei 600 Zellen/µl. 49% der Patienten hatten eine nicht nachweisbare HIV-Viruslast. In der Leberbiopsie hatten 31% ein bereits fortgeschrittenes Fibrosestadium F3 oder F4. Die mediane HCV-Viruslast betrug 5,7 log10 IE/ml. In der ITT (intent to treat)-Analyse zeigte sich eine RVR (Rapid Virological Response, d.h. negative HCV-RNA zu Woche 4) bei 10 Patienten (20%), eine EVR (Early Virological Response, d.h. negative HCV-RNA zu Woche 12) bei 26 (42%) der Patienten und eine SVR (Sustained Virological Response, d.h. negative HCV-RNA 24 Wochen nach Behandlungsende = Ausheilung) bei 28% aller Patienten. Unabhängige Prädiktoren für die Heilung in der multivariaten Analyse waren eine hohe HCV-Viruslast und das Erreichen der EVR (Martin-Carbonero L et al. #3). HCV-Genotyp 4 sollte somit aufgrund der mindestens genauso schlechten Heilungsrate genauso wie HCV-Genotyp 1 behandelt werden.
HOCHSENSITIVE TESTS SIND BESSER
Hochsensitive HCV-RNA-Tests können einen Relapse besser vorhersagen. In einer Studie von Belen Ramos wurden HIV-/HCV-koinfizierte Patienten mit nicht nachweisbarer Viruslast (Nachweisgrenze von 50 IU/ml) nach konventioneller Therapie mit pegyliertem Interferon und Ribavirin nachbeobachtet. 17/60 Patienten (28 %) hatten einen Relapse. Bei 5/17 Relapser fand sich retrospektiv im hochsensitiven TMA (Transcript Mediated Amplification)-Test mit einer Nachweisgrenze von 5 IU/ml ein positiver Befund. Bei 12/17 Relapser sowie bei allen Patienten mit SVR war der Test negativ ausgefallen. Der hochsensitive Test könnte somit nach Meinung der Autoren, ein sinnvolles Tool sein, um Patienten zu identifizieren, die von einer Verlängerung der HCV-Behandlung profitieren könnten (Belen R et al. Abstract #4).
NUKLEOSID-FREIE HAART UND RIBAVIRIN
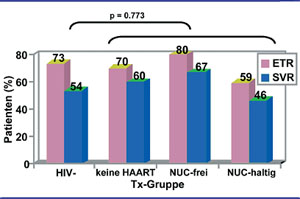
Abb. 2: Der Einfluss von HAART, Nukleosid-freier und Nukeosid-haltiger HAART auf das Therapieansprechen
pegylierter Interferon/Ribavirin Therapie bei HIV-positiven Patienten. Intent to treat-Analyse der
Ansprechraten zu Therapieende (ETR) und 24 Wochen nach Ende der Therapie (SVR). HIV-HIV negativ; NUC
Nukleosid/Nukleotid.
Jürgen Rockstroh aus Bonn stellte Daten zum Einfluss einer Nukleosid-freien HAART bei konventioneller HCV-Behandlung mit pegyliertem Interferon und Ribavirin (erstmals mit HIV-negativem Kontrollarm) vor. Die Ansprechraten bei HIV-negativen und -positiven Patienten sowie bei HIV-Infizierten mit und ohne HAART bzw. mit und ohne Nukleoside waren vergleichbar (Abb. 2). Unterschiede zeigten sich im Hinblick auf die Verträglichkeit. Patienten unter HAART litten deutlich häufiger an Nebenwirkungen, was aber nicht häufiger zu Therapieabbrüchen führte. Damit konnte erstmals das Konzept der NRTI-freien HAART unter pegylierter Interferontherapie belegt werden (Rockstroh J et al. #48).
AKUTE HEPATITIS C BEI MSM
Mittlerweile sind insgesamt etwa 200 Fälle einer akuten Hepatitis C bei HIV-Infizierten publiziert. Bei den Betroffenen handelte es sich in allen Kohorten fast ausschließlich um HIV-positive MSM (Men who have sex with men). Sex mit Männern allein scheint als Risikofaktor aber nicht auszureichen, denn es sind nur wenige Fälle sexuell übertragener HCV-Infektionen bei HIV-negativen MSM beschrieben. Kofaktoren für die Transmission sind möglicherweise Veränderungen der Mukosa, z.B. durch Koinfektion mit anderen sexuell übertragenen Infektionen oder sexueller Praktiken mit dem Risiko von Schleimhautverletzungen wie etwa durch Sex Toys oder Fisten. Berichtet wurde auch über einen vermehrten Drogengebrauch im Rahmen von sexuellen Praktiken, wobei Applikationssysteme wie Röhrchen zum Schnupfen zur nasalen oder rektalen Applikation mit anderen geteilt wurden.
Im Gegensatz zu diesen Berichten, die überwiegend aus Nordeuropa stammen, wurden in Italien in der großen Masterkohorte (5.184 Patienten) kein Anstieg der akuten Hepatitis C Infektionen bei HIV-Infizierten beobachtet (Puoti M et al. #25).
AKUTE HCV-INFEKTION LANGE BEHANDELN
Zur Behandlung der akuten Hepatitis C bei HIV-Patienten wurden mehrere Arbeiten vorgestellt, die unterstreichen, dass eine längere Behandlung zu besseren Ansprecheraten führt. Eine Therapiedauer unter 20 Wochen, wie sie zum Teil bei akut HCV-monoinfizierten Patienten erprobt wird, erscheint bei HIV-positiven Patienten nicht sinnvoll.
In einer englischen Untersuchung wurden 25 HIV-Infizierte mit akuter Hepatitis C behandelt. 21 (84%) hatten einen HCV-Genotyp 1 oder 4. 15 Patienten erhielten sofort nur pegyliertes Interferon über 24 Wochen. Ribavirin wurde gegeben, wenn die HCV-RNA zu Woche 12 noch positiv war. 5/15 (33 %) der Patienten erreichten eine SVR. In zwei Fällen kam es jedoch später zum Relapse. In der Folge wurde das Protokoll geändert. Zunächst wurde 12 Wochen nicht behandelt. Patienten mit einer positiven HCV-RNA zu Woche 12 wurde dann eine 48-wöchige pegylierte Interferon/Ribavirin-Kombinationstherapie angeboten. 3/5 (60%) der so behandelten Patienten erreichten eine SVR (Turner J et al. #26).
In einer retrospektiven Analyse von Sanjay Bhagani, London, wurden die Daten von 161 HIV-Patienten mit akuter Hepatitis C (79% Genotyp 1 oder 4) aus vier Kohorten ausgewertet. Zwei Patienten erhielten Standard-Interferon, 24 erhielten Interferon und Ribavirin, 17 erhielten pegyliertes Interferon und 118 erhielten pegyliertes Interferon und Ribavirin. Die Behandlungsdauer betrug 24 Wochen in drei Kohorten und 48 Wochen in einer Kohorte. Eine SVR erreichten 64% (95%-iges Konfidenzintervall 55-72%) aller Patienten. Eine Behandlungsdauer <20 Wochen war mit einer deutlich geringeren Wahrscheinlichkeit eines dauerhaften Therapieansprechens vergesellschaftet als eine längere Behandlungsdauer (Bhagani S et al. #27).
HBV UND HIV
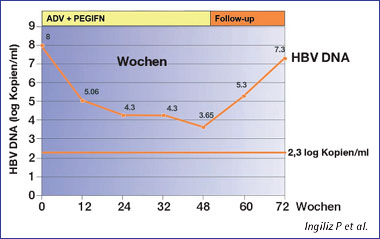
Abb. 3: Mittlere Veränderung der HBV-DNA Ingiliz P et al.
Patienten mit einer HBV- und HIV-Infektion bedürfen besonderer Aufmerksamkeit. Die HIV-Medikamente Tenofovir DF, Emtricitabin und Lamivudin hemmen auch die HBV-Polymerase. Bei Patienten mit HIV/HBV-Koinfektion sollte die HAART daher wenn möglich Tenofovir DF und entweder Emtricitabin oder Lamivudin enthalten. Schwieriger gestaltet sich derzeit die Behandlung von Patienten ohne HAART-Indikation. Veränderungen der aktuellen Guidelines des European Council sind im Hinblick auf Entecavir bei HIV-positiven Patienten zu erwarten, da eine antivirale Wirkung von Entecavir gegen HIV beobachtet wurde mit Ausbildung der Mutation M184V. Patrick Ingiliz, Paris, stellte Daten zur Behandlung der Lamivudin-resistenten, chronischen Hepatitis B bei HIV-koinfizierten Patienten mit Adefovir und pegyliertem Interferon vor. Insgesamt wurden 18 Patienten über 48 Wochen behandelt (Abb. 3). In keinem Fall gab es ein lang-anhaltendes Therapieansprechen. Verglichen HBV-Monoinfizierten, wo pegy- liertes Interferon eine Ausheilung bewirken kann, waren die hier gezeigten Daten ernüchternd. Es bleibt abzuwarten, ob potentere HBV-Polymerase-Hemmer zusammen mit pegyliertem Interferon oder eine längere Behandlungsdauer bessere Resultate erzielen (Ingiliz P et al. #34).
Martin Vogel und Jürgen Rockstroh
Korrespondenz: Prof. Dr. med. Jürgen Rockstroh
Universitätsklinikum Bonn
Medizinische Klinik und Poliklinik I
Sigmund-Freud-Str. 25 · 53127 Bonn
Email: juergen.rockstroh@ukb.uni-bonn.de
Drug Induced Liver Damage
Hepatitis-Koinfektionen erhöhen das Risiko für einen gravierenden Anstieg der Transaminasen, meist handelt es sich dabei jedoch um klinisch nicht signifikante Ereignisse von vorübergehendem Charakter. In der großen MASTER-Kohorte beispielsweise fand sich bei den koinfizierten Patienten lediglich in den ersten 12 Monaten nach HAART ein erhöhtes Risiko eines Transaminasenanstiegs. Der mittlere Anstieg in diesem Zeitraum betrug im Mittel 6-7 IU/l, was die geringe klinische Relevanz unterstreicht. Dennoch sollten die Leberwerte von Hepatitis-koinfizierten Patienten nach Einleitung der HAART sorgfältig überwacht werden. Bei Anstieg der Transaminasen über das 10fache der Norm sowie gleichzeitigem Anstieg des Bilirubins droht ein schwerer Leberschaden und die HAART sollte unverzüglich abgesetzt werden. Das Risiko einer Leberfibrose und -zirrhose durch die HAART scheint ebenfalls überschätzt zu werden. Verschiedene Querschnittsstudien zeigten zwar ein erhöhtes Risiko, nicht jedoch die aktuellen longitudinalen Studien. Dennoch sollte auch hier in Einzelfällen an die Möglichkeit einer HAART-induzierten Fibrose gedacht werden (Sulkowski M invited lecture).
So untersuchte I. Maida (#45) 32 Patienten mit erhöhten Aminotransferasen oder einer signifikanten Leberfibrose ohne bekannten chronischen Leberschaden z.B. im Sinne von Alkohol oder chronischer Hepatitis. Das mediane Alter bei Diagnose betrug 36 Jahre, die mediane Zeit seit HIV-Diagnose betrug 7,5 Jahre. Bei 2/9 Patienten mit Leberbiopsie fand sich eine nodulärregenerative Hyperplasie. Im weiteren Follow-up zeigten 9 Patienten Episoden hepatischer Dekompensation mit Aszites und Varizenblutungen. 8 Patienten hatten eine Pfortaderthrombose. Es bestand keine Assoziation mit der HIV-RNA oder CD4-Zellzahl. Alle Patienten nahmen eine HAART ein. Didanosin (ddI) war bei 29/32 Patienten Bestandteil der HAART. Bei 27 Patienten wurde ddI abgesetzt, was bei 13/32 (48%) Patienten eine deutliche Verbesserung der Klinik und Labor-Surrogatmarker zeigte. Die Transaminasen fielen von 75 auf 49 U/ml und 3/9 Patienten mit dekompensiertem Leberversagen entwickelten keine weiteren Episoden. Zusammenfassend sollte bei persistierend erhöhten Lebertransaminasen oder klinischem Verdacht auf eine Leberfibrose/-zirrhose insbesondere bei Patienten mit Einnahme von Didanosin auch an eine antiretroviral-bedingte Leberschädigung gedacht werden.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
