Thomas Mertens, Ulm – Herpesviridae – Betaherpesvirinae
Zytomegalievirus (CMV)
Erreger und Infektion
Großes umhülltes (bis 180 nm) und wenig umweltresistentes Virus mit ikosaedrischem Nukleokapsid (100 nm) und linearer Doppelstrang-DNA (240 kb). Die Vermehrung findet im Kern ausschließlich humaner Zellen statt. Die Genexpression ist kaskadenartig reguliert (immediate early-early-late). Infektiöse Nachkommenviren werden in Zellkultur in größeren Mengen erst 72-96 Stunden nach der Infektion freigesetzt. Es existiert eine Reihe von Epitopen, welche teils neutralisierende, teils nicht neutralisierende Antikörper induzieren. Die antigenen viralen Proteine sind mittlerweile in vitro exprimiert worden und finden z.T. in der Diagnostik Verwendung.
Epidemiologie
Die Primärinfektion kann prä-, peri- und postnatal erfolgen. Die pränatale Übertragung (0,1-0,5% der Neugeborenen) erfolgt diaplazentar bei Virämie der Mutter (Primärinfektion oder Reaktivierung). Eine perinatale Infektion (bis 5% der Neugeborenen) ist während der Geburt über Zervixsekret möglich. Postnatal erfolgt die Übertragung durch Muttermilch und bei engem Kontakt durch Speichel, Schmierinfektion, Intimverkehr sowie iatrogen durch Transfusion (Leukozyten) und Transplantation.
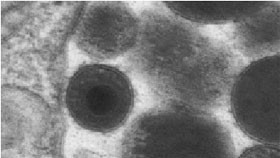
Abb. 1: CMV in einer humanen Fibroblastenzelle
Abbildung: Ch. Buser, Elektronenmikroskopie Universität Ulm
Infektionsformen
Wie alle humanen Herpesviren persistiert auch das Zytomegalievirus lebenslang nach der Primärinfektion. Es sind sehr viele Zelltypen im Menschen infizierbar. Reaktivierungen sind häufig, insbesondere in der Schwangerschaft und während der Stillperiode, bleiben aber meist asymptomatisch. Chronische Infektionen mit Virusreplikation findet man bei prä- und perinataler Infektion. Exogene Reinfektionen wurden bei Patienten mit erworbenen Immundefekten und Transplantatempfängern nachgewiesen. Die Mechanismen und relevanten Orte der Latenz sind nicht abschließend geklärt, diskutiert werden verschiedenen Zelltypen: Epithel-, Endothel-, glatte Muskelzellen, Monozyten/Makrophagen. Inkubationszeit 20-60 Tage bei Primärinfektion.
Untersuchungsindikationen und Materialien
- Feststellung des Infektionsstatus (CMV-Latenz): Nachweis von IgG-Antikörpern im Serum (ELISA).
- Primärinfektion: Nachweis von CMV-spezifischen IgM Antikörpern, ggf. IgG Serokonversion. Bei Problempatienten Virusnachweis durch Kurzzeitkultur, quantitativen DNA-Nachweis aus Blutzellen, Geweben, Speichel oder Urin bereits vor der Serokonversion sowie Antigennachweis aus Blutzellen.
- Reaktivierung: Nachweis einer Antigenämie/Virämie bei Immunsupprimierten bzw. Virusisolierung, möglichst aus krankheitsrelevanten Organen (z.B. BAL). Nachweis von CMV-DNA (PCR) im Liquor bei Verdacht auf CMV-Enzephalitis. Bei Transplantationspatienten mit erheblicher Immunsuppression kann das Monitoring auf eine CMV-Reaktivierung durch quantitativen Nachweis von pp65-Antigen in Blutleukozyten oder auch durch quantitativen DNA-Nachweis (PCR) aus Blut erfolgen.
- Resistenztestung: bei Langzeittherapie mit antiviralen Substanzen (CMV-Retinitis bei AIDS-Patienten oder systemische Infektionen bei Stammzelltransplantierten) kann die Sensitivität von Isolaten gegenüber antiviralen Substanzen in vitro und z.T. durch Sequenzanalyse bestimmt werden.
Antivirale Therapie
Alle drei verfügbaren Wirkstoffe hemmen eine virale DNA-Synthese durch Inhibition der CMV-DNA-Polymerase.
Ganciclovir (Valganciclovir) muss als Prodrug, um seine antivirale Aktivität zu entfalten, zum Ganciclovir-Triphosphat phosphoryliert werden. Dazu wird es in einem ersten Schritt durch eine viral kodierte Phosphotransferase (UL97-Genprodukt) zu Ganciclovir-Monophosphat phosphoryliert. Anschließend phosphorylieren Kinasen der Wirtszelle das Monophosphat über das Diphosphat zum Triphosphat.
Cidofovir ist ein acyclisches Nucleosidphosphat. Die weitere Phosphorylierung wird von Wirtsenzymen durchgeführt und ist somit unabhängig von viruskodierten Kinasen.
Foscarnet ist ein Pyrophosphatanalog, das keiner initialen intrazellulären Aktivierung bedarf. Dieser Wirkstoff blockiert die Phosphatbindungsstelle der viralen DNA-Polymerase und inibiert somit die Abspaltung von Pyrophosphat aus dNTPs.
Grundlage für die Virostatikaresistenz gegenüber Ganciclovir sind Mutationen im viralen Phosphotransferasegen (UL97) sowie im Polymerasegen (UL54). Durch Mutationen im UL97 kann Ganciclovir nicht mehr phosphoryliert werden. Virostatikaresistenzen gegenüber Cidofovir und Forcarnet (aber auch GCV) werden auch durch Mutationen im viralen Polymerasegen (UL54) verursacht.
Der Nachweis der Virostatikaresistenz kann über phänotypische Bestimmungen erfolgen. Dies setzt die Gewinnung eines Virusisolates voraus. Die schnellere Bestimmung ist über genotypische Testverfahren möglich. Die Methoden der Virostatika-Resistenzbestimmung sind nicht weit verbreitet und bedürfen noch der Optimierung bzw. Standardisierung.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
