Ulrich Marcus, Berlin
HIV-Test zur Prävention
HIV-Test als präventives Instrument
Die Diagnose der HIV-Infektion ist Voraussetzung für den Einsatz antiretroviraler Medikamente, mit deren Hilfe das Fortschreiten der HIV-Erkrankung aufgehalten, verloren gegangene Immunkompetenz teilweise wiederhergestellt und schädliche Auswirkungen der durch HIV ausgelösten chronischen Aktivierung des Immunsystems vermindert werden können. Ein weiterer wichtiger (Neben-)Effekt einer erfolgreichen antiretroviralen Therapie ist die Senkung der Infektiosität der behandelten Personen.
Diesen erwünschten Effekten einer antiretroviralen Therapie stehen unerwünschte Auswirkungen entgegen.
- Nebenwirkungen der Medikamente: diese lassen sich unterteilen in akute Nebenwirkungen, Langzeitnebenwirkungen und Wechselwirkungen mit anderen Substanzen und Medikamenten.
- Die medikamentöse Dauertherapie ist mit erheblichen Kosten verbunden (Tageskosten für Medikamente durchschnittlich ca. € 50,-), auch wenn in Deutschland in der Regel dafür nicht der einzelne Patient, sondern die Solidargemeinschaft der Krankenversicherten aufkommt.
- Erfolgreiche Therapie reduziert zwar die körperlichen Auswirkungen der HIV-Infektion und damit auch die soziale Sichtbarkeit von Krankheit, auf der anderen Seite erhöht die Notwendigkeit der medikamentösen Dauertherapie aber auch das Risiko, als HIV-Infizierter erkannt zu werden – sei es am Arbeitsplatz, auf Reisen oder gegenüber Familienangehörigen, Freunden, Bekannten und Sexualpartnern.
- Die Notwendigkeit einer regelmäßigen Einnahme der Medikamente und regelmäßiger Arztbesuche bringen Einschränkungen der Lebensqualität mit sich.
Der geeignete und empfohlene Zeitpunkt für den Therapiebeginn wird derzeit bei Erreichen bzw. Unterschreiten einer T-Helferzellzahl von 350 Zellen/µl gesehen. Im Laufe der Zeit hat sich die Einschätzung, wann mit einer medikamentösen Therapie begonnen werden sollte, mehrfach geändert. Vor der Entwicklung des Konzeptes der „hochaktiven“ antiretroviralen Therapie (HAART) im Jahre 1996 wurden die damals verfügbaren Medikamente in der Regel erst nach der Manifestation AIDS-definierender Erkrankungen oder nach Unterschreiten einer T-Helferzellzahl von 200 Zellen/µl eingesetzt. Der Effekt der als Monotherapie oder Zweifachkombination eingesetzten Medikamente war auf Grund der meist rasch erfolgenden Resistenzentwicklung kurzfristig und vorübergehend.
Die Entwicklung der „hochaktiven antiretroviralen Kombinationstherapie“ (HAART) im Jahre 1996, mit der erstmals die Virusvermehrung nahezu vollständig blockiert werden konnte, löste bei den Behandlern Euphorie aus und das Konzept „treat hard and early“ versprach baldige Heilung. Die Kriterien für eine Therapieindikation wurden daraufhin so breit gefasst, dass nahezu alle Personen mit einer HIV-Diagnose behandelt wurden.
In den folgenden Jahren bis etwa zum Jahr 2000 zeigte sich, dass die damals notwendigen sehr strikten Einnahme-regeln für die Medikamentenkombinationen viele Patienten überforderten, so dass Therapieregime relativ rasch versagten und sich Resistenzen ausbildeten. Außerdem wurden zunehmend Langzeitnebenwirkungen der damals bevorzugt eingesetzten Medikamente erkannt und beschrieben, die die Lebensqualität der Behandelten z.T. massiv beeinträchtigten (v.a. die sog. Lipodystrophie) und die Hoffnung auf eine Eradikation des Virus mit dem vorhandenen Therapiearsenal stellte sich als eine Illusion heraus. Daraufhin wurden die Behandlungsempfehlungen radikal geändert und eine Behandlung wurde erst bei Unterschreiten einer T-Helferzellzahl von 200 bis 250 Zellen/µl begonnen.
In den Folgejahren wurden neue Medikamente und Behandlungskonzepte wie das sog. Boosten von Protease-Inhibitoren (Ausnutzen von Wechselwirkungen auf den Abbau von Medikamenten, wodurch Dosierung und Einnahmefrequenz verringert werden können) entwickelt, die die Behandlung einfacher, wirksamer und besser verträglich machten. Pathomechanismen von Medikamentennebenwirkungen wurden erforscht und die Medikamente mit dem höchsten Risiko von Langzeitnebenwirkungen verschwanden aus dem therapeutischen Arsenal (zumindest in den reichen Ländern). Studien zur Feststellung des optimalen Zeitpunktes für einen Therapiebeginn und zur Überprüfung der Wirksamkeit intermittierender Medikamentengabe gelangten zu dem zunächst unerwarteten und überraschenden Ergebnis, dass eine kontinuierliche Therapie nicht schlechter vertragen wurde als eine intermittierende. Ein weiteres Ergebnis war, dass die antiretrovirale Therapie nicht nur das Auftreten AIDS-definierender Erkrankungen dramatisch reduziert, sondern sich auch günstig auf die Entwicklung und den Verlauf anderer Erkrankungen auswirkt, die bis dahin nicht in Verbindung mit der HIV-Erkrankung gebracht worden waren. Dies führte zu einer erneuten Revision der Therapieleitlinien: seit 2006/2007 wurde wieder ein früherer Therapiebeginn empfohlen und in den Leitlinien wurde die Grenze für den Therapiebeginn auf 350 T-Helferzellen/µl angehoben. Es wird diskutiert, ob eine Therapie sogar noch früher, ab 500 T-Helferzellen/µl beginnen sollte – damit wäre dann fast wieder der Stand von 1996 erreicht. Entsprechende Studien laufen derzeit, Ergebnisse sind aber erst in zwei bis drei Jahren zu erwarten.
Durch die Entdeckung von Vorteilen eines früheren Therapiebeginns und die Heraufsetzung der Therapieschwelle wird auch die „späte Diagnose“ der HIV-Infektion zu einem wachsenden Problem. Gemessen an einer Therapieschwelle von 200 T-Helferzellen/µl erfolgten in Deutschland ca. 20-30% der HIV-Diagnosen „zu spät“, gemessen an einer Schwelle von 350 T-Helferzellen sind es ungefähr 50%. Um die Vorteile der Therapie voll auszuschöpfen, müsste sich ein deutlich höherer Anteil der Menschen, die ein Risiko für eine HIV-Infektion haben, häufiger als bisher auf HIV testen lassen und nicht abwarten, bis verdächtige gesundheitliche Beschwerden auftreten, die den Verdacht auf eine HIV-Infektion nahelegen.
HIV-Testhäufigkeit und Testfrequenzen in der Allgemeinbevölkerung
| Jahr | Geburten Gesamt | Geburten gesamt abzüglich 10% PKV# | KBV- Abrechnungshäufigkeit | Testrate | HIV-infizierte Neugeborene von Müttern ohne HIV-Test in der Schwangerschaft* |
|---|---|---|---|---|---|
2001 |
737 356 |
663 620 |
398784 |
60,1% |
k.A. |
2002 |
721 950 |
649 755 |
404028 |
62,2% |
k.A. |
2003 |
709 420 |
638 478 |
410446 |
64,3% |
k.A. |
2004 |
708 350 |
637 515 |
413760 |
64,9% |
9 |
2005 |
688 282 |
619 454 |
453725 |
73,2% |
8 |
2006 |
675 144 |
607 630 |
483028 |
79,5% |
8 |
2007 |
687 233 |
618 510 |
513289 |
83,0% |
4 |
2008 |
684 926 |
616 433 |
528576 |
85,7% |
2 |
2009 |
667 480 |
600 732 |
546181 |
90,9% |
0 |
* Stand 10/2010, durch Nachmeldungen können sich diese Zahlen noch erhöhen # Schwangerschaftsscreening-Abrechnungen liegen nur für GKV-Versicherte vor. Ca. 10% der Krankenversicherten in Deutschland sind privat krankenversichert |
|||||
Tab. 1 HIV-Tests in der Schwangerschaft, 2001-2009 (Quelle für Geburten: Statist. Bundesamt; Quelle für Testzahlen: Kassenärztliche Bundesvereinigung/KBV)
Laut Ergebnissen repräsentativer Befragungen der Bundeszentrale für gesundheitliche Aufklärung (BZgA) haben 40% der erwachsenen Bevölkerung (16-65 Jahre; 43% bei Frauen, 37% bei Männern) jemals einen HIV-Test gemacht; der Anteil derer, die sich im Laufe der vorangegangenen 12 Monate hat testen lassen, liegt bei 11%. Darin eingeschlossen sind ca. 2,2 Millionen Blut- und Plasmaspender, die routinemäßig bei jeder Spende auf HIV untersucht werden, und die Mehrzahl der Schwangeren, bei denen ein routinemäßiger HIV-Test im Rahmen der Schwangerschaftsvorsorgeuntersuchungen vorgesehen ist (Tab. 1).
Für die in Deutschland besonders von HIV betroffenen Gruppen – Männer, die Sex mit Männern haben (MSM), intravenös Drogen Konsumierende (IVD) und Migranten aus Hochprävalenzländern (HPL) – gibt es keine repräsentativen Daten zur Test-Inanspruchnahme, da repräsentative Stichproben aus methodischen Gründen nahezu unmöglich sind oder nur mit unverhältnismäßig hohem Aufwand bestimmt werden könnten. Für MSM stehen aktuelle Daten aus der von Juni bis August 2010 durchgeführten europaweiten EMIS-Studie (European MSM Internet-Survey) zur Verfügung, an der sich über 50.000 schwule und bisexuelle Männer aus Deutschland beteiligt haben. Auf Grund dieser außerordentlich hohen Teilnehmerzahl sind die Ergebnisse für eine große Gruppe von sexuell aktiven schwulen und bisexuellen Männern verallgemeinerbar, wenngleich keine Repräsentativität für alle Männer, die Sex mit Männern haben, beansprucht werden kann (Tab. 2). Die Ergebnisse zeigen u.a., dass jüngere homo- und bisexuelle Männer (unter 25 Jahren) etwas seltener jemals einen HIV-Test durchgeführt haben, dafür aber ein Test, wenn er durchgeführt wurde, im Durchschnitt weniger lang zurückliegt, oder mit anderen Worten, je älter die Befragten desto länger werden die Testintervalle.
| Gesamt (n=55.992) | <25 Jahre (n=12.839) | |
|---|---|---|
| HIV-Test jemals | 70% | 47% |
| HIV-Test in den letz ten 12 Monaten | 34,1% von allen | 31,2% von allen |
| (ohne prävalent HIV+) | 52,1% von allen jemals Getesteten | 66,5% von allen jemals Getesteten |
| Kein HIV-Test | 30% | 53% |
Tab. 2 HIV-Test-Inanspruchnahme bei in Deutschland lebenden Teilnehmern der EMIS-Studie
Vergleichbare Daten für IVD und HPL stehen derzeit nicht zur Verfügung. Bei positiv auf HIV getesteten IVD scheint die HIV-Diagnose ähnlich früh zu erfolgen wie bei schwulen und bisexuellen Männern, bei HPL scheint die Diagnose eher später zu erfolgen. Zahlen zum Anteil der Getesteten und zu Testfrequenzen liegen aber nicht vor.
Die vorliegenden Informationen legen nahe, dass in allen Betroffenengruppen ein unterschiedlich hoher Anteil von Infektionen erst sehr spät diagnostiziert wird. Ziel muss daher sein, so gezielt wie möglich die Testfrequenz bei den Gefährdeten zu erhöhen, die selten zum Test gehen. Eine solche Erhöhung der HIV-Testfrequenz hätte sekundärpräventive Effekte, da dadurch der Anteil der zu spät erfolgenden HIV-Diagnosen und eines zu späten Behandlungsbeginns reduziert würden.
Test- und Behandlungsraten bei MSM in Deutschland
Der Anteil schwuler und bisexueller Männer in Deutschland, die im Rahmen der EMIS-Befragung von einer HIV- Diagnose berichten, beträgt 8% (11,5% aller jemals Getesteten). Von denjenigen, die sich in den vorangehenden 12 Monaten auf HIV hatten testen lassen, erhielten 2,6% (460/17.693) ein positives Testergebnis.
Von den Befragungsteilnehmern, die seit 2001 mit HIV diagnostiziert worden waren, wurde erfragt, wie hoch ihre T-Hel-ferzellzahl zum Zeitpunkt der Diagnose war. Bei 15,9% lag die Zahl niedriger als 200 T-Helferzellen/µl, bei 29,8% war sie niedriger als 350 Zellen/µl. 22,1% erinnerten sich nicht an den Wert. Von denen, die sich nicht erinnern, erhalten aktuell ca. 60% eine antiretrovirale Therapie.
Von allen deren HIV-Diagnose bekannt ist erhielten zum Zeitpunkt der Befragung 74% eine medikamentöse Therapie. Bei 80% der Behandelten lag die letzte gemessene Viruslast unter der Nachweisgrenze. Daraus folgt, dass etwa 60% der mit HIV Diagnostizierten eine Viruslast unter der Nachweisgrenze haben.
Die Rolle des HIV-Tests für die HIV-Primärprävention
Abgesehen von den sekundärpräventiven Effekten einer vermehrten HIV-Testung suggeriert die öffentliche Diskussion über den HIV-Test häufig, eine vermehrte Testung hätte auch einen primärpräventiven Effekt. Aber abgesehen von einem evtl. früheren Therapiebeginn, welche Effekte können HIV-Test und HIV-Diagnose auf Verhalten und das Eingehen von Infektionsrisiken haben?
Ohne Zweifel wirkt sich die Diagnose einer HIV-Infektion auf das sexuelle Verhalten von Neu-Diagnostizierten aus. Die überwiegende Mehrheit der mit HIV diagnostizierten Personen versucht, bewusste Infektionsrisiken für andere zu minimieren. Eine häufig angewandte Strategie ist die Suche nach ebenfalls HIV-infizierten Partnern, mit denen dann allerdings die Sexualkontakte in der Regel ohne Kondom erfolgen. Diese Konzentration ungeschützter Kontakte auf eine Teilgruppe führt in dieser wiederum zu einem höheren Risiko, andere sexuell übertragbare Infektionen zu erwerben.
Welchen Effekt auf Risikoverhalten kann ein negatives HIV-Testergebnis haben? Ohne ein Gespräch über Risikovermeidungsstrategien und Risikoverhalten wird in der Regel kein Effekt zu erwarten sein. Meistens steckt hinter einem HIV-Test die (oft unausgesprochene) Frage, ob die individuell verfolgte Risikovermeidung erfolgreich war. Ein negatives Testergebnis, welches nicht eingebettet war in ein Gespräch über Risikoverhalten und Risikovermeidung, wird daher in der Regel das praktizierte Verhalten bestärken, unabhängig davon ob es sich um ein rationales oder irrationales Risikomanagement handelt.
Wenn sich der Diskurs über HIV-Prävention auf den HIV-Test als Instrument der HIV-Prävention verengt und gleichzeitig die Einbettung des HIV-Tests in eine Beratung zum individuellen Risikomanagement nicht als wesentlich angesehen wird, bedeutet dies implizit, dass die Verantwortung für HIV-Neuinfektionen einseitig den mit HIV Diagnostizierten zugeschoben wird. Ein zusätzlicher Aspekt einer solchen Verantwortungsverschiebung wäre eine zunehmende Kriminalisierung von HIV-Übertragungen.
Zufrieden mit Testberatung?
| Keine Beratung | (sehr) zufrieden | (sehr) unzufrieden | Verteilung auf Testeinrichtung | |
|---|---|---|---|---|
| Niedergelas- sener Arzt | 35,6% | 50,9% | 5,3% | 48,4% |
| Krankenhaus | 42,6% | 36,5% | 9,2% | 9,9% |
| HIV-Testein- richtung | 12,2% | 77,8% | 4,7% | 28,7% |
| Blutbank/ Heimtest | 43,7% | 37,8% | 5,6% | 9,5% |
| Gesamt | 30,7% | 54,6% | 5,6% | 34.326 (100%) |
Tab. 3 HIV-Testberatung und Zufriedenheit mit der Beratung in verschiedenen Testeinrichtungen aus dem Blickwinkel der Teilnehmer der EMIS-Befragung aus Deutschland
Auf die Frage, ob im Zusammenhang mit dem letzten HIV-Test eine Beratung stattgefunden hat, antworten 69% der jemals auf HIV getesteten EMIS-Teilnehmer in Deutschland mit ja. Ob eine Beratung stattgefunden hat und die Zufriedenheit mit dieser Beratung variieren je nach Test-Ort (Tab. 3).
Im Durchschnitt haben 55% der Getesteten eine Beratung erhalten, mit der sie zufrieden waren. Zufriedenheit mit der Beratung sagt jedoch noch nicht unbedingt etwas über die Qualität der Beratung und etwas darüber aus, ob das präventive Potential einer Beratung ausgeschöpft wurde. Insgesamt berichten nur ein Drittel der (negativ) auf HIV Getes-teten, dass im Rahmen der Testung explizit über ihre konkreten sexuellen Risiken gesprochen wurde. Selbst bei denjenigen, die mit der Beratung zufrieden oder sehr zufrieden waren haben mindestens 40% nicht über ihre konkreten Infektionsrisiken gesprochen. Bei allen negativ Getesteten liegt der Anteil derjenigen, die im Rahmen der Testberatung nicht über ihre konkreten sexuellen Risiken gesprochen haben, bei mindestens 55%. Nach Angaben der Befragten ist der Hauptgrund, nicht über konkrete Risiken zu sprechen, dass sie im Rahmen der Testberatung dazu keine Gelegenheit gesehen haben. Daraus muss man schließen, dass in vielen Fällen vom Testarzt zu diesem Bereich keine konkreten Fragen gestellt wurden.
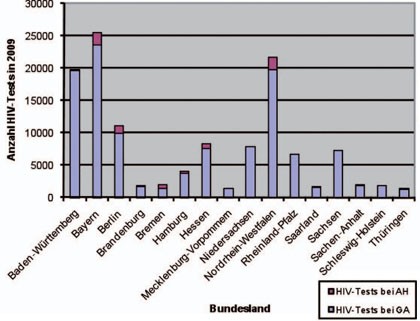
Abb. 1 Gesamtangebot von HIV-Tests bei Gesundheitsämtern (GA) und AIDS-Hilfen (AH) in den Bundesländern im Jahr 2009
Besonders gut in Bezug auf eine zufriedenstellende Beratung und auch auf das Ansprechen konkreter sexueller Risiken schneiden Testangebote bei Gesundheitsämtern und AIDS-Hilfen ab. Von den geschätzt etwas mehr als 2 Millionen HIV-Testen pro Jahr in Deutschland (ohne Blutspende) finden knapp 130.000 bei diesen Einrichtungen statt (Abb. 1).
Die Ergebnisse der EMIS-Befragung zeigen, dass im Bereich der HIV-Testung und Testberatung noch vieles verbessert werden kann und dass die Möglichkeiten, präventives Verhalten zu stärken, noch unzureichend genutzt werden.
Die Beratungskompetenz bezüglich HIV bei allen niedergelassenen und Krankenhausärzten zu verbessern, die HIV-Tests anfordern können, ist ein eher unrealistisches Unterfangen. Realistischerweise müsste man sich bei Bemühungen zur Verbesserung der Beratungskompetenz im ambulanten und stationären Bereich auf diejenigen Bereiche konzentrieren, in denen der Anteil von Personen mit erhöhtem Risiko für eine HIV-Infektion besonders hoch ist. Darüber hinaus ist es sinnvoll, die Test- und Beratungskapazitäten der Einrichtungen auszubauen, bei denen schon eine hohe Qualität der Beratung existiert, d.h. bei Gesundheitsämtern und AIDS-Hilfen. Die in den letzten Jahren entstandenen neuen Testangebote über AIDS-Hilfen und Präventionsprojekte für MSM zeigen, dass eine ausreichend hohe Nachfrage für niedrigschwellige Testangebote existiert – das Problem ist nicht der Mangel an Klienten, sondern in der Regel die Finanzierung solcher Angebote.
Testangebot für weitere STI
Ein weiterer Vorteil eines Ausbaus Betroffenengruppen-naher HIV-Beratungs- und Testkapazitäten wäre die Möglichkeit, gezielt und damit sehr kosteneffektiv auch Tests auf andere wichtige sexuell übertragbare Infektionen anzubieten – z.B. Syphilistests und eine Testung auf Gonokokken und Chlamydien. Diese weiteren sexuell übertragbaren Infektionen sind insbesondere bei homosexuellen Männern, die HIV-Testangebote wahrnehmen, häufiger (Gonokokken und Chlamydien) oder zumindest genauso häufig (Syphilis) wie unentdeckte HIV-Infektionen und man könnte die Gelegenheit des Beratungskontaktes nutzen, ein umfassenderes Testangebot zu unterbreiten.
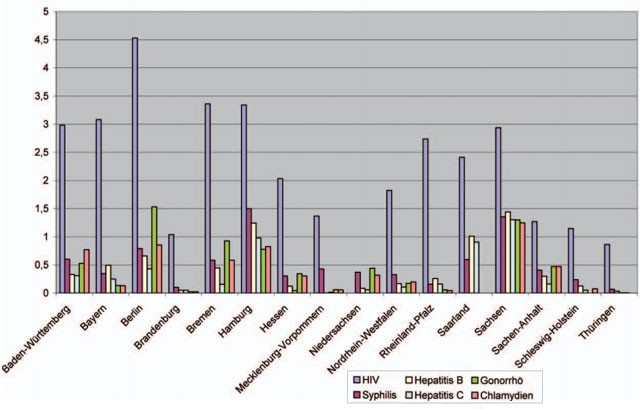
Abb. 2 Anzahl der bei Gesundheitsämtern durchgeführten Tests pro 1.000 Pers. (15-59 J.)
In einer großen Zahl von Gesundheitsämtern ist ein solches umfassenderes Test- und Screeningangebot bereits seit vielen Jahren für Sexarbeiterinnen, die STI-Testangebote der Gesundheitsämter nutzen, etabliert. Epidemiologisch gesehen gibt es unter dem Aspekt der Prävalenz der entsprechenden Infektionen in den jeweiligen Zielgruppen keine Rechtfertigung dafür, Frauen in der Sexarbeit entsprechende Untersuchungsangebote zu machen, sexuell aktiven homo- und bisexuellen Männern aber nicht. Inwiefern bereits jetzt Test- und Screeningangebote auf andere sexuell übertragbare Infektionen für homo- und bisexuelle Männer in den Gesundheitsämtern gemacht werden, variiert zwischen den Bundesländern und hängt derzeit eher von den zur Verfügung stehenden Mitteln für Laboruntersuchungen als von der Prävalenz von Infektionen in der Klientel der Beratungsstellen ab (Abb. 2). Dasselbe gilt für Testangebote der AIDS-Hilfen, denen noch weniger finanzielle Ressourcen für eine Ausweitung ihrer Angebote zur Verfügung stehen als den Gesundheitsämtern.
Schlussfolgerungen
Die Verbesserung der Therapiemöglichkeiten für die HIV-Infektion führt zu einer Vorverlegung des Behandlungsbeginns in Erkrankungsphasen, in denen sich die HIV-Infektion noch nicht unbedingt durch klinische Symptome bemerkbar macht. Um die Vorteile der Therapie voll ausschöpfen zu können, sollten sich Personen mit erhöhtem Risiko für eine HIV-Infektion daher regelmäßig auf HIV testen lassen. Um das individuelle Risiko besser einzuschätzen und um die HIV-Testberatung auch besser präventiv zu nutzen, ist die Einbettung des HIV-Tests in eine kompetente Beratung zum HIV-Test und zum sexuellen Risikomanagement notwendig. Es ist epidemiologisch gerechtfertigt und sinnvoll, im Rahmen einer solchen Beratung auch Angebote zur Testung auf weitere sexuell übertragbare Infektionen zu machen. Die kosteneffektivste Art solche STI-Testangebote für HIV-negative und ungetestete Personen auszuweiten wäre eine großzügigere finanzielle Ausstattung von Testangeboten der Gesundheitsämter und AIDS-Hilfen.
Im Bereich der medizinischen Versorgung von HIV-Infizierten durch HIV-Schwerpunktpraxen und -ambulanzen könnten STI-Screening-Untersuchungen ohne großen Zusatzaufwand in die ohnehin vierteljährlich empfohlenen Verlaufsuntersuchungen integriert werden. In einem mathematischen Modell wurden für Australien, einem Land mit ähnlichem Gesundheitssystem und ähnlicher epidemiologischer Situation in Bezug auf die Syphilis, verschiedene Screening-Szenarien bei MSM auf ihre erwartete Wirksamkeit zur Reduktion der Syphilis-Inzidenz untersucht.1 Am effizientesten wäre es demnach, sich auf die Untergruppe der Männer mit hohen Partnerzahlen (>10 Partner/Jahr) zu fokussieren und diesem Personenkreis 4-6 mal pro Jahr eine Kontrolltestung anzubieten. Ziel solcher regelmäßigen Kontrollen wäre es, den Zeitraum zwischen Infektion und Diagnose/Therapie vor allem in den Teilgruppen mit hohen Partnerzahlen zu reduzieren.2
1 Gray RT, Hoare A, Prestage GP, Donovan B, Kaldor JM, Wilson DP: Frequent Testing of Highly Sexually Active Gay Men is Required to Control Syphilis. Sex Transm Dis 2010; 37:298-305
2 Bisessor M, Fairley CK, Leslie D, Howley K, Chen MY: Frequent Screening for Syphilis as Part of HIV monitoring Increases the Detection of Early Asymptomatic Syphilis Among HIV-Positive Homosexual Men. J Acquir Immune Defic Syndr 2010 [Epub ahead of print]










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
