Thomas Klimkait, Basel
Tiefe Viruslast bei HIV – Grund zur Sorge oder irrelevante
„Rest“-Aktivität?
Zunächst hat mit der Entwicklung hochempfindlicher Testsysteme für eine Quantifizierung der Virusmenge nach HIV-Infektion in klinischem Probenmaterial die Frage an Bedeutung gewonnen, wie eine „geringe (tiefe) Viruslast“ überhaupt zu definieren und welche klinische Bedeutung ihr beizumessen ist. Während in den späten 1980er Jahren die bloße Detektierbarkeit im Vordergrund stand, um die Blutspende wieder sicher zu machen und um eine HIV-Infektion eindeutig belegen zu können, werden die modernen quantitativen Testmethoden heute vor allem zur longitudinalen Überwachung des Therapieansprechens und -erfolgs eingesetzt.
Messbarkeit von HIV
In der historischen Entwicklung der HIV-Diagnostik ist zunächst bemerkenswert, in welch kurzer Zeit seit der Entdeckung des AIDS-Erregers HIV im Jahr 1984 hochempfindliche, verlässliche Tests verfügbar geworden sind, welche eine präzise Einschätzung der Virusmenge im Plasma und damit ein Monitoring des Infektionsverlaufs ermöglichen.
Bis Ende der 1990er Jahre waren Viruslasten von weniger als ca. 400 Kopien pro Milliliter nicht messbar. Sie lagen schlichtweg unter der Nachweisgrenze für die damals verfügbaren Laborteste. Und doch korrelierte bereits dann die Messgrenze von <400 Kopien gut mit einem klinischen Therapieansprechen des betreffenden Patienten. Auch wurde deutlich, dass die Zeit bis zur Nicht-Detektierbarkeit mit der Höhe der Ausgangsviruslast in direktem Zusammenhang steht.1 Seitdem ist die Technik, inzwischen fast ausnahmslos von quantitativer PCR geprägt, so weit verfeinert worden, dass die meist vollautomatisierten Diagnostiksysteme längst Werte unter 50 Kopien/mL erreichen.
Diese Entwicklung hat natürlich die Frage aufgeworfen, ob zwischen <400 und <50 überhaupt ein therapierelevanter Unterschied liegt, wie er gegebenenfalls gemessen werden kann, und was die klinischen Konsequenzen sind.
Antwort eines Virologen
Aus virologischer Sicht kann eindeutig bestätigt werden: Der Zugewinn an Testempfindlichkeit betrifft einen sehr sensitiven Bereich retroviraler „Rest-Replikation“, denn persistierende tiefe Viruslasten können nicht selten Auskunft über therapeutisches Versagen bzw. sich entwickelnde Virusresistenzen geben. Immerhin fällt genau in den Bereich zwischen 50 und 400 Kopien die Mehrzahl der Virus-“Blips“, also einzelner viruspositiver Messwerte bei ansonsten gut supprimierten Patienten. Es kommt darauf an, ob es sich um Einzelmessungen positiver Viruslasten oder um kontinuierliche Replikationsprozesse im Patienten handelt. Während positive Einzelwerte NICHT mit einem virologischen Versagen korrelieren2,3, möglicherweise weil solche Einzelblips außer durch fehlende Medikamentenspiegel auch durch immunaktivierende Prozesse im Patienten verursacht werden2, korreliert ein wiederholtes Auftreten von Blips mit einem erhöhte Risiko für ein Therapieversagen.4,5
Letztendlich haben diese Beobachtungen dazu geführt, dass praktisch alle Labortestsysteme Virusmengen im Blut mit einer Empfindlichkeit von <50 Kopien/mL erfassen, was sich inzwischen in entsprechenden Richtlinien widerspiegelt.6
Fast unvermeidlich wirft natürlich auch diese neue Messgrenze die Frage auf, was sich denn im Bereich von unter 50 Viruskopien pro mL Plasma im Patienten abspielt – schließlich sind 49 Kopien nicht dasselbe wie keine Viren. Virologische Evidenz aus Analysen mit hochempfindlichen Methoden belegen, dass sogar im supprimierten Patienten eine Evolution der HIV-Genome stattfindet, was sich in genetischen Veränderungen des viralen Genoms zeigen lässt.8,19
Antwort eines Klinikers
Zu Bedeutung viraler Replikation in diesem Messbereich hatte die Arbeitsgruppe von Luc Perrin in Genf bereits im Jahr 2001 Daten vorgestellt.7 Bei therapienaiven Patienten wurde nach begonnener ART die Viruslast in regelmäßigen Abständen verfolgt und das Therapieansprechen für die Gruppen mit den Viruslastkriterien ≤3/mL bzw. <50/mL vergli-chen. Die Studie belegte, dass nach 144 Wochen Therapie das virologische Versagensrisiko in beiden Gruppen ununterscheidbar klein ist. Während also der Gedanke, dass jedes Anzeichen einer nicht kompletten Virusreplikation eher suggeriert, dass virologisch die Kontrolle verloren zu gehen droht, lässt sich ein klinischer Unterschied zwischen einer „kontinuierlich niedrig messbaren Viruslast“ (low level viremia) ohne große therapeutische Konsequenz und einem „virologischen Versagen“ auch im Bereich zwischen 50 und 400 Kopien/mL in klinischen Studien bis heute nicht einfach abgrenzen. Eine Limitierung mag allerdings sein, dass die meisten Studien nur bis zu 48 Wochen laufen, somit also einen späteren Effekt nicht dokumentieren.
Folglich sind in der Klinik neben dem rein virologischen andere, nicht minder bedeutsame Aspekt für einen Therapieerfolg zu beachten: Die Verträglichkeit einer Therapie und die Erhaltung künftiger Therapieoptionen. Es sei dem Behandler nahegelegt, sich nicht durch einzelne messbare Viruslast-Werte aufscheuchen zu lassen, sondern zugleich den Wert eines gegenwärtig immunologisch erfolgreichen und gut tolerierten Regimes nicht zu unterschätzen!
Dabei bleibt allerdings unbestritten, dass eine längerfristig nicht supprimierte Viruslast prinzipiell klinisch als nachteilig beurteilt werden muss.
Obwohl es wissenschaftlich logisch erscheinen mag, dass selbst eine geringe (echte) Virusreplikation das Risiko von Resistenzentwicklung und damit verbundenen klinischen Konsequenzen erhöht, ist der klinische Nachweis eines echten Replikationsereignisses bei tiefen Viruslasten nicht immer trivial. Wie erwähnt haben Prozesse, welche das Immunsystem des Patienten beeinflussen, Einfluss auch auf die Expression latenter, archivierter Viruskopien, und letztendlich liefert der Nachweis resistenzassoziierter HIV-Mutationen mit ansteigender Viruslast den Beleg für einen Therapie-Verlust.
Replikation in Kompartimenten
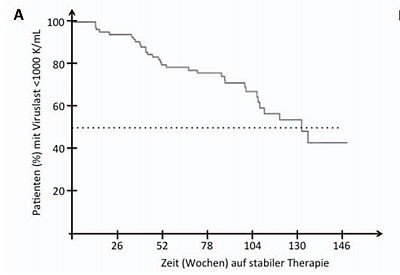
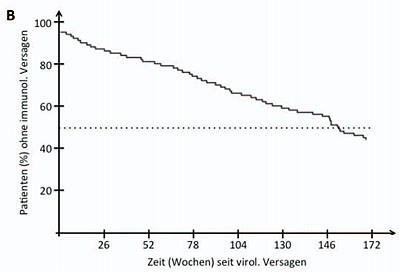 Abb. 1 Zeit bis zum Therapieversagen unter ART: ( A ) Virologisches Versagen (als ≥1.000 K/mL) bei Patienten mit messbar tiefer Virämie (50-500 K/mL) und stabiler Therapie als Funktion der Zeit. (Daten adaptiert von Ref. 11) ( B ) Immunologisches Versagen (CD4-Zellen auf vor-Therapie-Niveau) bei Patienten mit persistierender Viruslast über 500 K/mL. (Adaptiert von Ref. 12)
Abb. 1 Zeit bis zum Therapieversagen unter ART: ( A ) Virologisches Versagen (als ≥1.000 K/mL) bei Patienten mit messbar tiefer Virämie (50-500 K/mL) und stabiler Therapie als Funktion der Zeit. (Daten adaptiert von Ref. 11) ( B ) Immunologisches Versagen (CD4-Zellen auf vor-Therapie-Niveau) bei Patienten mit persistierender Viruslast über 500 K/mL. (Adaptiert von Ref. 12)
Zusätzlich sind auch andere Ursachen für eine niedrige Virämie im peripheren Blut beschrieben. Sie können in persistierender Virusreplikation in Kompartimenten liegen, die mit der gegebenen Medikation nicht ausreichend erreicht werden (z.B. eine unzureichende ZNS-Gängigkeit mancher antiretroviraler Substanzen). So konnten in klinische Studien genetisch unterscheidbare Virusvarianten in unterschiedlichen Kompartimenten nachgewiesen werden, welche als Belege für eine solche unabhängige Virusevolution und Therapie-Erreichbarkeit dienen.9,10
Interessant sind Langzeitstudien mit Patienten, in denen keine komplette Virussuppression erreicht wurde, die also auch während stabiler Therapiephasen mit guter Adhärenz messbare Viruslasten aufweisen. Stellt man die Daten zwei verschiedener Studien von Lo Re et al. und Deeks et al. nebeneinander11,12, so zeigt sich trotz anderer Einschlusskriterien, dass für ca. 50% der Patienten entweder ein virologisches Versagen auf >1.000 Kopien/mL oder ein immunologisches Versagen auf CD4-Werte von vor dem Therapiebeginn erst nach ca. 3 Jahren zu beobachten ist (Abb. 1). Wenngleich keine erstrebenswerte Situation, belegt es doch auch für diese schwierige Patientengruppe ein beachtliches Zeitfenster des Therapieerfolgs.
Endogene Viruslast
Einen weiteren Bereich, der bis heute nur unvollständig verstanden ist, bildet die residuelle Virusproduktion aus Zellen und Geweben, in welchen HIV als chromosomal integriertes „Provirus“ vorliegt. Ausgehend vom Prinzip, dass Retroviren wie HIV ihr Genom stets und zwangsläufig in ein Chromosom in der Wirtszelle integrieren, ist in jedem Patienten eine Vielzahl intakter oder defekter HIV Genom-Kopien teils in langlebigen Zellen des Immunsystems stabil archiviert.13,14 Die Integration kann dabei sogar bewirken, dass die HIV-Kopie unter die Kontrolle zellulärer regulatorischer Sequenzen gelangt. Ein solcher Einfluss zellulärer „Enhancer“ und „Silencer“ Sequenzen auf retrovirale Genexpression konnte in verschiedenen Modellsystemen nachgewiesen werden.15 Auch wenn solche Prozesse bei HIV weniger gut studiert sind, sind sie als prinzipieller Mechanismus endogener Retrovirusexpression wohl bekannt. Das bedeutet, dass die chromosomale Integrationsumgebung einen signifikanten Einfluss auf die Produktion von Viruspartikeln nehmen kann. Eine solche eher endogene Partikelfreisetzung kann weder durch Hemmer der Reversen Transkriptase, welche auf chromosomal integrierte Virus-DNA kaum Einfluss nehmen, noch durch Hemmer der HIV-Integrase (eine Integration ist längst erfolgt) beeinflusst werden. Auch Proteasehemmer verhindern diesen Schritt nicht, weil sie ja lediglich die Reifung von HIV-Virionen verhindern, nicht aber die Freisetzung unreifer viraler Partikel. Das führt unweigerlich und bei jeder Retrovirusinfektion dazu, dass eine gewisse Menge viraler Partikel nachweisbar bleiben muss, egal welche der heute gängigen Therapien Anwendung findet – die Frage ist lediglich: Wie hoch ist eine solche endogene Viruslast? Neue Studien belegen in der Tat, dass eine tiefe, mit empfindlichen Methoden durchaus messbare, Virusfreisetzung aus solchen Zellen erfolgt, dass dieses Virus in jedem HIV-Infizierten nachweisbar ist und über lange Zeit erhalten bleibt.16
Nicht-infektiöse Partikel
Ein Teil der „endogenen Freisetzung“ dürfte auf nicht-infektiöse Partikel zurückgehen, als Expressionsprodukte defekter Virusgenome, die sich nach Integration angesammelt haben. Hauptursache für die Defekte ist dabei die inhärent hohe Fehlerrate der Reversen Transkriptase von HIV mit einer Fehlerrate von >1 pro 10‘000 Nukleotide, also 1-3 Fehler pro Virusgenom. Weil solche Varianten trotz der Defekte zur Produktion unreifer Virusformen führen, werden sie bei einer Viruslastbestimmung mittels PCR gleichermaßen wie intaktes Virus erfasst und können von replizierendem Virus nicht unterschieden werden. Neue Studien belegen eindrücklich, dass diese residuelle tiefe Viruslast auch durch Therapieintensivierung nicht supprimierbar ist16,17, und dass die Kopienzahl solcher Partikel im Durchschnitt bei wenigen Kopien (meist <10 Kopien/mL) liegt.16 Die Anzahl kann aber individuell schwanken und kann in Einzelfällen die Grenze von Viruslast-Assays überschreiten. Für die betreffenden Patienten besteht dann die Gefahr, dass sie trotz kompletter Unterdrückung des replikativen Viruspools langfristig als niedrig virämisch eingestuft werden, da sie nur schwer von „echten dauerhaft niedrig virämischen“ Patienten zu unterscheiden sind.
Immunstimulation
Über solche Analysen hinaus fehlen bis heute systematische Studien, die einen möglichen Einfluss akuter immunologischer Prozesse, z.B. im Zusammenhang mit Allergien oder Alltagsinfekten auf HIV-Expression und -Viruslast im niedrigen Bereich beurteilen lassen. Statistische Auswertungen von Impfungen (z.B. Influenza) deuten auf eine impfbedingte leichte Erhöhung der HIV-Viruslast.18 Entsprechend ist prinzipiell denkbar, dass eine massive Immunstimulierung auch den Zellpool mit integrierter HIV-DNA aktivieren kann und somit zu einer erhöhten HIV-Expression und Partikelfreisetzung führen kann. Das könnte blipartig höhere Viruslastwert bewirken, ohne dass eine mangelnde Suppression der HIV Produktion zugrunde liegt.
Antwort eines Retrovirus
„Nichts gemessen“ ist nicht „nichts vorhanden“!
Als wichtigste Voraussetzung für die erforderliche Dauertherapie bei HIV wie auch für die vielfältigen Möglichkeiten virologischen Versagens ist die obligatorische Zell-Integration des Retrovirus in seiner Wirtszelle anzusehen. Durch diesen Archivierungsschritt schafft das Virus eine bisher nicht angreifbare Basis im Patienten. Diese Basis ist ein reiches und mit der Infektionszeit kontinuierlich wachsendes Archiv viraler Sequenzen und Möglichkeiten, weil sämtliche Therapieerfahrungen genetisch konserviert werden, Informationen, die sich technisch z.B. mittels proviraler Sequenzierung wieder abrufen lassen. Darüber hinaus gibt es seit geraumer Zeit gute Hinweise darauf, dass auch bei sehr lokaler, nicht wahrnehmbaren Replikationsprozessen eine virale genetische Diversifizierung und Evolution stattfinden kann.8 Das lässt sich gut abbilden, wenn virale RNA innerhalb infizierter Zellen gegen die Plasma-Viruslast aufgetragen wird (Abb. 2). Die Grafik zeigt, dass auch in Patienten ohne messbares freies Virus innerhalb von Zellen z.T. über 1.000 Kopien HIV-RNA, also eine erhebliche Genexpression, nachweisbar bleibt.
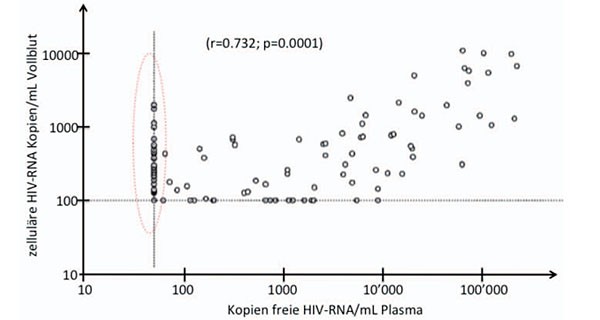
Abb. 2 Korrelation zwischen Plasmaviruslast und RNA in infizierten Zellen. Oval eingerahmter Bereich: Patienten-spezifische HIV-RNA Kopienzahl bei gleichzeitig unmessbarer Viruslast im Plasma. (Adaptiert von Ref. 19)
Resistenzentstehung
Die Länge der chronischen Infektionsphase bietet dem Virus in Zeiten ungenügender Adhärenz und zu tiefer Medikamentenspiegel, aber auch über Kompartiment-Bildung und unterschiedliche Organgängigkeit der Medikamente vielfältige Gelegenheiten zur Replikation. Aufgrund der rasanten Generationszeit von kaum 24 Stunden sind dem Virus auch kurze Phasen willkommen, in welchen im Gewebe ungefährliche Medikamentenspiegel herrschen, also solche, welche die Replikation nicht blockieren können und doch einen gewissen Selektionsdruck bewirken. Genau in diesen Phasen wird die Entstehung von Resistenzen gefördert, weil „Wildtyp“ unterdrückt wird und eine resistente Variante die Regie übernehmen kann. Nur eine komplette Blockade viraler Genexpression kann bewirken, dass sich das Virus nicht verändern kann. Das bedeutet, dass Forschung und Klinik alles Wissen nutzen müssen, um einerseits genau dieses Ziel zu erreichen, andererseits jedoch ohne unnötige Maßnahmen oder exzessive Therapieansätze zu verwenden.
Zusammenfassung
Aus klinischer Sicht lässt sich zusammenfassend sagen:
- dass nach einer erfolgreichen Viruslastsuppression in einem Patienten jede längerfristige Rückkehr messbarer Virusmengen ernst zu nehmen ist, weil sie künftiges virologisches Ansprechen bedrohen kann;
- dass singuläre, seltene erhöhte VL-Messungen folgenlos bleibende Einzelereignisse enthalten, die auf technische Fehler/Grenzen bei Probennahme und Testung zurückgehen oder auf eine kurzzeitige VL Erhöhungen ohne Erklärung.
- Kommt es zu wiederholter Viruslasterhöhung im Bereich von 50-400 Kopien, so ist zu klären, ob Medikamentenspiegel und somit der medikamentöse Druck ausreichend sind (ggf. Spiegelbestimmung), und ob ein Adhärenzproblem beim Patienten vorliegt.
- Der CD4-Verlauf ist im Blick zu halten. Es gibt Patienten, die ein gutes virologisches Ansprechen zeigen und CD4 und %CD4 sich erwartungsgemäß entwickelt, deren Viruslast jedoch stets messbar auf sehr tiefem Wert bleibt. Bei solchen statistisch seltenen Fälle kann die Möglichkeit einer therapeutisch irrelevanten erhöhten „endogenen HIV-Expression“ bestehen. Da in solchen Fällen eine Therapie-Intensivierung zu keinem weiteren Viruslastabfall führen wird, kann auf weitere Maßnahmen verzichtet werden. Weil allerdings die Unterscheidbarkeit von einer wirklichen tiefen Virämie schwierig ist, ist zu empfehlen, diese Patienten virologisch engmaschiger zu verfolgen.
1 King M, Bernstein B, Kempf D, Moseley J, Gu K, Sun E. Comparison of time to achieve HIV RNA < 400 copies/mL and <50 copies/mL in a phase III, blinded, randomized clinical trial of ABT-378/r vs. NFV in ARV-naive patients. Conference on Retroviruses and Opportunistic Infections 2001; abstr. 329.
2 Deeks S (Review). Durable HIV treatment benefit des-pite low-level viremia. JAMA 2001; 286, 2: 224-226
3 Lee PK, Kieffer TL, Siliciano RF, Nettles RE. HIV-1 viral load blips are of limited clinical significance. J Antimicrob Chemother 2006; 57:803–805.
4 Sungkanuparph S, Overton ET, Seyfried W, Groger RK, Fraser VJ, Powderly WG. Intermittent Episodes of Detectable HIV Viremia in Patients Receiving Nonnucleoside Reverse-Transcriptase Inhibitor–Based or Protease Inhibitor–Based Highly Active Antiretroviral Therapy Regimens Are Equivalent in Incidence and Prognosis. Clin Infect Dis. 2005; 41, 9: 1326-1332.
5 Geretti AM, Smith C, Haberl A, Garcia-Diaz A, Nebbia G, Johnson M, Phillips A, Staszewski S. Determinants of virological failure after successful viral load suppression in first-line highly active antiretroviral therapy. Antiviral Therapy 2008; 13:927-936
6 Hammer SM, Eron JJ Jr, Reiss P, Schooley RT, Thompson MA, Walmsley S, Cahn P, Fischl MA, Gatell JM, Hirsch MS, Jacobsen DM, Montaner JS, Richman DD, Yeni PG, Volberding PA; International AIDS Society-USA. Antiretroviral treatment of adult HIV infection: 2008 recommendations of the International AIDS Society-USA panel. JAMA. 2008 Aug 6;300(5):555-70.
7 Perrin L, Kings M, Brun S et al. Failure to achieve HIV RNA less than 3 copies/mL does not predict loss of virologic response to Kaletra therapy through 3 years 41st ICAAC 2001, Abstr. 1927
8 Frenkel LM, Wang Y, Learn GH,McKernan JL, Ellis GM, Mohan KM, Holte SE, De Vange SM, Pawluk DM, Melvin AJ, Lewis PF, Heath LM, Beck IA, Mahalanabis M, Naugler WE, Tobin NH, Mullins JI. 2003. Multiple viral genetic analyses detect low-level human immunodeficiency virus type 1 replication during effective highly active antiretroviral therapy. J Virol 77:5721–5730.
9 Kemal KS, Foley B, Burger H, Anastos K, Minkoff H, Kitchen C, Philpott SM, Gao W, Robison E, Holman S, Dehner C, Beck S, Meyer WA 3rd, Landay A, Kovacs A, Bremer J, Weiser B. HIV-1 in genital tract and plasma of women: compartmentalization of viral sequences, coreceptor usage, and glycosylation. Proc Natl Acad Sci U S A. 2003; 100(22):12972-12977
10 Smit TK, Brew BJ, Tourtellotte W, Morgello S, Gelman BB, Saksena NK. Independent evolution of human immunodeficiency virus (HIV) drug resistance mutations in diverse areas of the brain in HIV-infected patients, with and without dementia, on antiretroviral treatment. J Virol. 2004; 78(18):10133-10148.
11 Lo Re V 3rd, Gasink L, Kostman JR, Leonard D, Gross R. Natural history of patients with low-level HIV viremia on antiretroviral therapy. AIDS Patient Care STDS. 2004 Aug;18(8):436-42.
12 Deeks SG, Barbour JD, Grant RM, et al. Duration and predictors of CD4 T-cell gains in patients who continue combination therapy despite detectable plasma viremia. AIDS. 2002;16:201-207.
13 Hockett RD, Kilby JM, Derdeyn CA et al. Constant mean viral copy number per infected cell in tissues regardless of high, low or undetectable plasma HIV-RNA. J Exp Med 1999; 189: 1545-1559.
14 Finzi D, Blankson J, Siliciano JD et al. Latent infection of CD4 T cells provides a mechanism for lifelong persistence of HIV-1, even in patients on effective combination therapy. Nat Med 1999; 5: 512-517.
15 Fuchs NV, Kraft M, Tondera C, Hanschmann KM, Löwer J, Löwer. Expression of the Human Endogenous Retrovirus (HERV) Group HML-2/HERV-K Does Not Depend on Canonical Promoter Elements but Is Regulated by Transcription Factors Sp1 and Sp3. Journal of Virology 2011; 85,7: 3436-3448
16 Palmer S, Maldarelli F, Wiegand A, et al. Low-level viremia persists for at least 7 years in patients on suppressive antiretroviral therapy. Proc Natl Acad Sci U S A 2008; 105:3879-3884.
17 McMahon D, Jones J, Wiegand A, Gange SJ, Kearney M, Palmer S, McNulty S, Metcalf JA, Acosta E, Rehm C, Coffin JM, Mellors JW, Maldarelli F. Short-course raltegravir intensification does not reduce persistent low-level viremia in patients with HIV-1 suppression during receipt of combination antiretroviral therapy. Clin Infect Dis. 2010; 50(6):912-919.
18 de Carvalho AP, Dutra LC, Tonelli E. Influenza vaccination in HIV infected children: immunologic and viral load changes. J Pediatr (Rio J, portugise). 2003;79(1):29-40.
19 Kupfer B, Matz B, Däumer MP, Roden F, Rockstroh JK, Qurishi N, Spengler U, Kaiser R. Frequent detection of cell-associated HIV-1 RNA in patients with plasma viral load <50 copies/ml. J Med Virol. 2007;79(10):1440-5.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
