Matthias
Stoll, Hannover
 AMNOG1 – die ersten 500 Tage
AMNOG1 – die ersten 500 Tage
Prolog: Von Dornröschen zu Rösler
Es war einmal ein König mit seiner Frau. Diese sprachen Tag für Tag: „Ach, hätten wir doch ein Kind!“ – Doch sie bekamen keines.
Da geschah es, dass eine gute Fee sprach: „Dein
Wunsch soll erfüllt werden. Bevor ein Jahr vergangen ist, wirst du dank meines
Zaubertrankes eine Tochter zur Welt bringen.“ Und was die Fee gesagt hatte,
geschah auch, und die Königin gebar ein Mädchen. Dies war so schön, dass der
König sich vor Freude nicht zu fassen wusste und ein großes Fest anstellte. Er
lud nicht bloß seine Verwandten, Freunde und Bekannten, sondern auch alle
weisen Feen dazu ein, damit sie dem Kind Glück brächten. Es waren ihrer
dreizehn an der Zahl. Da der König aber nur zwölf güldene Teller hatte, musste
eine von ihnen daheim bleiben. Die Feen
beschenkten am Ende des Fests nach-einander das Kind mit ihren
Zaubergaben. Da erschien plötzlich die dreizehnte Fee im Saal und wollte sich
dafür rächen, dass sie nicht eingeladen war und sprach mit lauter Stimme: „Die
Königstochter soll sich in ihrem fünfzehnten Jahr an einer Spindel stechen und
tot niederfallen.“ Alle waren erschrocken, doch da trat die zwölfte Fee hervor,
die ihren Wunsch noch übrig hatte. Zwar konnte sie den bösen Spruch nicht
aufheben aber abmildern: „Es soll aber kein Tod sein, sondern ein hundert Jahre
währender Schlaf…“.
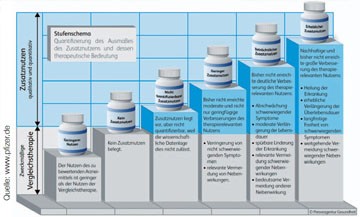
Abb. 1 Nutzenkategorien – was sich dahinter verbirgt großes Bild
großes Bild
Der Rest3 ist bekannt. Die Geschichte soll sich so auf der Sababurg im Herzen des mächtigen Reinhardswaldes zugetragen haben. Aus dem Königreich wurde später eine Republik, aber die Moral des Märchens vom Dornröschen überdauerte all die Jahre. Auch wenn seither so mancher im Volke eine echte Krämerseele entwickelt hatte und lieber mit spitzbübischem Lächeln dem Pfaffen am Sonntage ein „Geiz ist geil“ statt eines Hellers für die Kollekte entbot, so wusste er doch noch immer um den Wert benedeiender Zaubersprüche guter Feen. Nun waren die guten Feen zwar inzwischen ausgestorben oder sie lebten fortan in Zwergstaaten am Mittelmeer oder in den Alpen. Aber deren Konzept war als Geschäftsidee nunmehr von der Zunft der Heilkundigen übernommen worden. Anders als in allen anderen Republiken war man im Lande Dornröschens daher bereit, diesen ohne Feilschen stets das zu geben, was sie verlangten.
Freilich konnten deswegen auch die Heilkundigen das Schicksal der Sterblichkeit der Nachfahren des schönen Dornröschens nicht aufheben, sondern nur abmildern. So senkten sie deren Blutdruck und Cholesterin und glätteten das Blutzuckertagesprofil so manchen armen Sünders, wenn dieser der Völlerei verfallen war. Und wenn er nicht gleich gestorben war, so lebte er noch weiter.
Nun geschah es aber, dass bald nicht nur jeder zehnte im Volke von der ehrlichen Heilkunde lebte, sondern zusätzlich auch so mancher Scharlatan, der statt die hohe Kunst der evidenzbasierten Medizin zu üben, nur mit leeren Versprechen quacksalbte. Das erzürnte das Volk und deren Tribunen forderten, dass fortan zweifelhaft guter Zauber nicht mehr bezahlt werden solle. So schaffte der Rat der Weisen schließlich ein Gesetz zur Zertifizierung zusätzlichen Zaubernutzens zeitgenössischer Heilkunst.
Wer nicht fragt, bleibt dumm: Was ist das AMNOG?
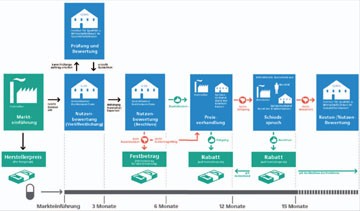
Abb. 2 Preisfestlegung für neue Arzneimittel gemäß des AMNOG großes Bild
großes Bild
Als im Jahre 2010 ein Haushaltsdefizit von bis zu 11 Milliarden Euro im Gesundheitswesen drohte, wurde in einer weiteren Reform des Gesundheitswesens u.a. ein Preismoratorium und ein erhöhter Herstellerabschlag für bereits zugelassene Arzneimittel festgelegt. Ein Kernpunkt der Reform war das Gesetz zur Neuordnung des Arzneimittelmarktes (AMNOG): Die Preise neuer Arzneimittel können zwar vom Hersteller auch weiterhin frei gestaltet werden, sie gelten aber nur noch für einen Zeitraum von maximal zwölf Monaten. Die Preise werden in einem relativ aufwändigen Verfahren einer Preisverhandlungsprozedur unterzogen auf der Grundlage einer für Deutschland zuvor nicht üblichen Arzneimittelfrühbewertung. Dazu müssen die pharmazeutischen Unternehmen einen Zusatznutzen für ihre neuen Arzneimittel nachweisen (Abb. 1). Kommt keine Einigung über den Preis des Arzneimittels mit der gesetzlichen Krankenversicherung zustande, entscheidet eine zentrale Schiedsstelle. Der auf diesem Wege verhandelte Arzneimittelpreis gilt dann – ggf. auch rückwirkend – mit dem Ablauf des ersten Jahres nach Zulassung. Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) und der Gemeinsame Bundesausschuss (G-BA) können in diesem Prozess als unabhängige Instanzen mit der Bewertung des Zusatznutzens von Arzneimitteln beauftragt werden. Die Prozedur veranschaulicht die Grafik des Bundesministeriums für Gesundheit und Soziales (Abb. 2).
Ähnliche Verfahren sind auch in anderen Ländern üblich, beispielsweise in Österreich und Frankreich. Trotzdem steigt das unternehmerische Risiko für den Arzneimittelhersteller durch das AMNOG stärker als auf den ersten Blick vermutet werden könnte. Zum einen ist mit dem AMNOG sehr frühzeitig die Festsetzung eines Preises auf dem meist von Generika bestimmten – also oft sehr viel niedrigeren – Festbetragsniveau möglich. Zum anderen bot eine frühe Zulassung neuer Arzneimittel in Deutschland durch dessen bisher einzigartig freizügige Regelung zur Preisfestsetzung eine besonders günstige strategische Ausgangssituation für die metachronen Preisverhandlungen in den Gesundheitssystemen anderer Nationen.
Hohe Transparenz
Anders als in anderen Kulturkreisen, wo – beispielsweise auf dem Basar – das Verhandeln des Preises publikumswirksam und manchmal lautstark öffentlich zelebriert wird, sind Preisverhandlungen hierzulande oft eine Angelegenheit, die im Hinterzimmer praktiziert wird. Die eigene Verhandlungstaktik eines Käufers soll dabei ebenso geheim bleiben, wie die preisrelevanten Vorzüge eines angebotenen Produkts zum Betriebsgeheimnis erklärt werden können. Ganz anders beim AMNOG. Dessen gesetzliche Grundlagen sind im §35a SGB-V5 niedergelegt und schon vor dem Inkrafttreten an zahlreichen Stellen öffentlich dargelegt und diskutiert worden.
Das Gleiche gilt für die mit dem AMNOG zusammenhängenden administrativen Verfahrensfragen. Allein auf 174 Seiten ist die „Verfahrensordnung zur Bewertung des Nutzens von Arzneimitteln nach §35a SGB V“6 für den Gemeinsamen Bundesausschuss anschaulich und im vielleicht doppelten Sinn des Wortes auch erschöpfend dargestellt. Alle relevanten Entscheidungen und Gutachten zu jeder Nutzenbewertung nach dem AMNOG sind im Netz öffentlich.7 Damit ist aber eine Detailfülle erreicht, die auch vom am Prozess der Entscheidungsfindung interessierten Beobachter kaum noch zu bewältigen ist.
Unsicherheiten im Umgang mit den Instrumentarien
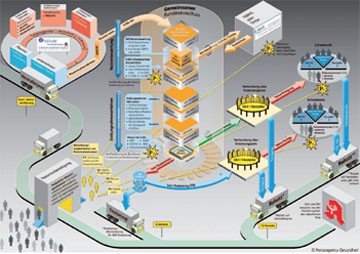
Abb. 3 Mitsprachemöglichkeiten für Patienten bei der Nutzenbewertung neuer Arzneimittel
 großes Bild
großes Bild
Manche Details des AMNOG wirken in unserer zertifizierungswütigen, qualitätsgeprüften Epoche geradezu erfrischend. So ruft das IQWIG alle Ärzte zur Iniativbewerbung8 für Nutzenbewertungsgutachten auf, wenn Sie im entsprechenden Fachgebiet tätig sind, bereits wissenschaftlich publiziert haben und die deutsche Sprache beherrschen. Das faktisch größere Problem könnte sein, welcher Arzt mit diesen Qualifikationen im Falle des Erfolgs seiner Bewerbung beim IQWIG auf Zuruf seinen eigentlichen Beruf für drei Monate aussetzen kann, um in dieser Frist ein Nutzenbewertungsgutachten für ein neues Arzneimittel zu erstellen. Auch Patienten bzw. -vertreter können aktiv an diesem Prozess teilnehmen (Abb. 3)
Wie bei anderen Pionierleistungen auch müssen – trotz klar formulierter Ziele und vorgegebener Verfahren – manche Unwägbarkeiten erst im laufenden Prozess erkannt und bewältigt werden. Anlass zu kontroversen Diskussionen ergaben sich bisher aus mehreren Bewertungsverfahren:
HCV-Proteasehemmer (Boceprevir, Telaprevir)
So wurde der Wert des Surrogatmarkers einer „Sustained Viral Response (SVR)“ in der Kombinationsbehandlung der chronischen Hepatitis C bei der Beurteilung der HCV-Proteasehemmer Boceprevir und Telaprevir in Frage gestellt. Bei beiden HCV-Proteasehemmern kam der G-BA zu einer diskrepanten Bewertung gegenüber dem IQWIG: Während das IQWIG nur einen eingeschränkten Nutzen beim Boceprevir und diesen auch nur für Patienten ohne Leberzirrhose erkannte, sah der G-BA einen uneingeschränkten Zusatznutzen.9
Beim Telaprevir hingegen sah das IQWIG einen uneingeschränkten Zusatznutzen, den dann aber der G-BA letztlich als „nicht quantifizierbar“ einstufte.10
Antiretrovirale Therapie (Rilpivirin)
Für Diskussion sorgte auch die diskrepante Einschätzung des HIV-NNRTI Rilpivirin durch das IQWIG. Anders als bei den HCV-Proteasehemmern zur Behandlung der Hepatitis C wurde der Studienendpunkt „virologisches Ansprechen“ als Surrogatmarker eines patientenrelevanten therapeutischen Effektes für dieses antiretrovirale Medikament zur Behandlung der HIV-Infektion anerkannt. Dabei wurden anhand der vorliegenden Studiendaten post hoc Subgruppenanalysen – zum Beispiel zum geschlechtspezifischen virologischen Ansprechen – durchgeführt, die – bei einem geringen Frauenanteil in den Studien – keinen Nachweis einer signifikanten Wirksamkeit für die weiblichen Studienteilnehmerinnen erbrachten. Die beiden Dossiers kamen anhand der Beurteilung von teilweise identischen Studien zu unterschiedlichen Ergebnissen, je nachdem ob das Rilpivirin in einer Fixkombination („Keine Belege für Zusatznutzen“) oder aber als einzelner Bestandteil einer aus mehreren Tabletten bestehenden ART („Zusatznutzen belegt“) gegeben wurde. Auch hier sah der G-BA in seinem Beschluss vom 5.7.2012 abweichend einen Zusatznutzen auch für die Fixkombination aus Rilpivirin, Emtricitabin und Tenofovir.11
Die bisherigen Erfahrungen belegen, wie schwer es ist, einfache und allgemein gültige Schlüsse aus klinischen Studien zu ziehen, die an hoch selektionierten Patientenkollektiven durchgeführt wurden. Diese nicht ganz neue Erkenntnis relativiert andererseits auch den Wert des Konzepts des sehr aufwändigen Bewertungsverfahrens durch das AMNOG.
Datengetrieben
Deutlich erkennbar wird das Paradigma, streng datengetrieben vorzugehen, wie dies vom IQWIG auch bei der Kalkulation der Fallpauschalen (G-DRG) praktiziert wird. Hersteller neuer Arzneimittel sind also gut beraten, die eingereichten Dossiers so detailliert wie möglich zu halten. Diese Vorgabe kollidiert möglicherweise an einigen Stellen noch mit den bisher gewohnten Strukturen, in denen zuweilen wesentliche Quelldaten klinischer Studien zum „Unternehmensgeheimnis“ transatlantischer Mutterkonzerne gehörten. Es gilt also beim Nutzenbewertungsverfahren eher das Gegenteil der Rechtsbelehrung für Beschuldigte in Strafsachen: „Sie haben das Recht umfängliche Angaben zu machen! Alles was Sie nicht sagen, kann auch nicht zu Ihren Gunsten bewertet werden!“
In diesem Zusammenhang wurde anscheinend bisher auch fair und pragmatisch vorgegangen: Antragsteller durften – obwohl im Verhandlungsprozess vom Gesetz so nicht vorgesehen – zum Teil nachträglich weitere spezifizierte Daten zum Beleg eines Zusatznutzens nachliefern.
Potenzielle Kollateralschäden der frühen Nutzen-bewertung?
Inzwischen gibt es Beispiele dafür, dass die Hersteller pharmazeutischer Produkte nicht unter allen Umständen bereit sind, den Weg der frühen Nutzenbewertung zu beschreiten. Das bereits begonnene Bewertungsverfahren für das Antidiabetikum Linagliptin wurde vom Hersteller abgebrochen, weil dieser mit der vom IQWIG gewählten Vergleichstherapie, einem Generikum, nicht einverstanden war.12 Schon zuvor wurde das Antiepileptikum Retigabin zum 1. Juli vorerst vom deutschen Markt genommen13 und wird damit nicht allgemein erstattungsfähig sein. Auch in diesem Fall liegt eine Kontroverse um die Auswahl der Vergleichstherapie durch den G-BA zu Grunde.
Zumindest für das Retigabin bedeutet dies, dass eine Gruppe von Menschen mit schwer medikamentös einstellbarer Epilepsie schlechter gestellt sein werden, wenn ihnen dieses Medikament in Deutschland nun nicht weiter verordnet werden kann. Hier fehlen bisher Mechanismen, die verhindern, dass Patienten die Zeche für künftige Extrarunden im Verhandlungspoker bezahlen müssen.
Letztlich weist dieses Beispiel auf den eigentlichen Zielkonflikt hin, den das AMNOG vorgeblich ja lösen will: Wenn nicht genug Geld da ist, um alle Wünsche zu erfüllen, so muss man sich stärker einschränken oder es klüger verteilen oder beides. Der Diskurs darüber muss immer wieder offen und vor allem inhaltlich geführt werden. Keinesfalls darf auch nur der Eindruck entstehen, die formalen Anforderungen könnten schwerer wiegen als der Inhalt.
Das lehrt uns auch die Geschichte vom Dornröschen. Deren Schicksal hätte vermutlich weit schlimmer sein können als im Grimmschen Märchen: Wenn nämlich der König, als er bemerkte, dass er weniger goldene Teller im Schloss hat als Feen im Lande sind, die dreizehnte Fee nicht (grob) fahrlässig bei der Einladung übergangen hätte, sondern ihr stattdessen ein Schreiben hätte überbringen lassen, in welchem er ihr den Status einer Fee aberkennt, weil ihr bei Hofe vorliegendes Feendossier unvollständig war.
Noch eine weitere interessante Implikation hätte die Bewertungslogik vom Zusatznutzen gemäß §35a SGB V im Märchen von Dornröschen: Die letzte gute Fee konnte die tödliche Verwünschung der bösen Fee bekanntlich nur abschwächen aber nicht aufheben. Deshalb verfiel Dornröschen im Alter von 15 Jahren in einen 100-jährigen Schlaf. Hätte die gute Fee hingegen die Wahl gehabt, den Fluch der bösen Fee ganz ungeschehen zu machen, so wäre der Zusatznutzen dieser Option nicht etwa größer sondern geringer gewesen, weil der Dauerschlaf ja mit einer 100 Jahre dauernden Verlängerung des Überlebens für Dornröschen und ihren ganzen Hofstaat einhergeht. So werden künftige Generationen wohl nicht mehr verstehen, warum der König bei den Gebrüdern Grimm alle Spinnräder einsammeln ließ, wenn er damit seine eigene Tochter um diesen medizinisch bisher beispiellosen Zusatznutzen hätte bringen können, wenn es ihm denn tatsächlich gelungen wäre, alle Spindeln in seinem Reich zu vernichten.
1. Gesetz zur Neuordnung des Arzneimittelmarktes in der gesetzlichen Krankenversicherung (Arzneimittelmarktneuordnungsgesetz – AMNOG); 22. Dez. 2010 - Bundesgesetzblatt Jahrgang 2010 Teil I, Nr. 67, 2262-2277
2. §3: Nutzen und Zusatznutzen. Aus: 5. Kapitel der Verfahrensordnung - Bewertung des Nutzens von Arzneimitteln nach §35a SGB V des Gemeinsamen Bundesausschusses in der Fassung vom 20. Januar 2011, veröffentlicht im Bundesanzeiger 2011 BGBl. I S. 2983
3. Heinz Rölleke (Hrsg.): Die älteste Märchensammlung der Brüder Grimm. Synopse der handschriftlichen Urfassung von 1810 und der Erstdrucke von 1812. Fondation Martin Bodmer, Cologny-Genf 1975, S. 106-111, 359
4. http://www.bmg.bund.de/krankenversicherung/arzneimittelversorgung/arzneimittelmarktneuordnungsgesetz-amnog/infografiken-zum-amnog.html
5. § 35a SGB V Bewertung des Nutzens von Arzneimitteln mit neuen Wirkstoffen, Synopse alte und neue Fassung: § 35a, Bundesgesetzblatt Jahrgang 2010 Teil I, 2263
6. 5. Kapitel der Verfahrensordnung des Gemeinsamen Bundesausschusses in der Fassung vom 20. Januar 2011, veröffentlicht im Bundesanzeiger 2011 BGBl. I S. 2983
7. IQWIG-Meldung zur Nutzenbewertung von Rilpivirin vom 5. Juli 2012 mit Verweisen: https://www.iqwig.de/index.1471.html
8. „Beteiligung an der frühen Nutzenbewertung“ – https://www.iqwig.de/index.1157.html
9. Gemeinsamer Bundesausschuss: Nutzenbewertungsverfahren zum Wirkstoff Boceprevir – http://www.g-ba.de/informationen/nutzenbewertung/8/
10. Gemeinsamer Bundesausschuss: Nutzenbewertungsverfahren zum Wirkstoff Telaprevir – http://www.g-ba.de/informationen/nutzenbewertung/21/
11. http://www.g-ba.de/dowloads/39-261-1522/2012-07- 05_AM-RL-XII_Emtricitabin-Rilpivirin-Tenofovir.pdf
12. http://www.aerzteblatt.de/nachrichten/50879/AMNOG-Pro-und-Contra-Sollen-neue-Wirkstoffe-mit-Generika-verglichen-werden-duerfen
13. http://www.deutsche-apotheker-zeitung.de/politik/news/ 2012/06/01/gsk-steigt-mit-trobaltR-aus/7381.html










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
