Thomas
Meyer, Hamburg
Chlamydien
im Labor Biologie
und Diagnostik von Chlamydia trachomatis
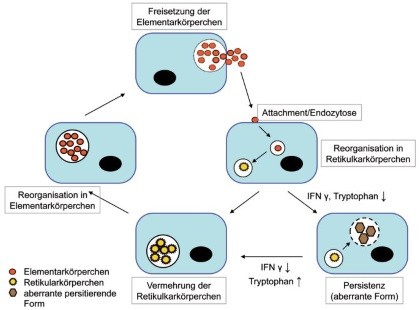
Abb. 1 Vermehrungszyklus der Chlamydien – Elementarkörperchen (EK) stellen die extrazelluläre Form der Chlamydien dar, die sich nach Infektion von Wirtszellen in Retikularkörperchen (RK), die intrazelluläre Form, umwandeln. RK sind metabolisch aktiv, vermehren sich durch Zweiteilung und redifferenzieren zu EK, die aus der Wirtszelle freigesetzt werden und benachbarte Zellen infizieren können. Unter bestimmten Bedingungen (niedrige Tryptophanspiegel, IFNγ, Antibiotika) können morphologisch aberrante, nicht-replikative intrazellulär persistierende Formen gebildet werden, die sich bei Verbesserung der Wachstumsbedingungen wieder in RK bzw. EK umwandeln können.
Am Ende des Infektionszyklus kondensieren RK zu EK, die durch Exozytose oder Ruptur freigesetzt werden und weitere Zielzellen oder neue Wirtsorganismen infizieren können. Darüber hinaus können Chlamydien intrazellulär in Form morphologisch aberranter, nicht-replikativer Dauerformen persistieren, die z.B. durch niedrige Tryptophanspiegel, IFNγ oder Antibiotika induziert werden. Unter günstigeren Lebensbedingungen können diese Dauerformen wieder in RK bzw. EK umgewandelt werden.1
Serovare/Genotypen
Die
Spezies Chlamydia trachomatis wird in verschiedene Serovare bzw.
Genotypen eingeteilt, die sich hinsichtlich des Organtropismus und
der verursachten Erkrankungen unterscheiden. Die Einteilung basiert
auf Unterschieden des Hauptmembranantigens (MOMP – major outer
membrane protein). Dabei entsprechen die mit Hilfe spezifischer
Antikörper definierten Serovare weitgehend den anhand der
DNA-Sequenzanalyse des MOMP-Gens bestimmten Genotypen.2
Die Genotypen A, B, und C infizieren vorzugsweise das
Schleimhautepithel der Augen. Die Infektion kann sich in der akuten
Phase als Konjunktivitis manifestieren und bei chronischen Verläufen
zum Trachom führen. Infektionen mit Trachom-assoziierten Genotypen
kommen fast ausschließlich in Afrika vor und stellen dort eine der
Hauptursachen der Erblindung dar.3
Die durch Sexualkontakte übertragenen Infektionen des
Urogenitaltrakts, Rektums, Pharynx und der Konjunktiven werden
hauptsächlich durch die Genotypen D-K verursacht. Genitale C.
trachomatis Infektionen können auch perinatal übertragen werden
und bei Neugeborenen eine Konjunktivitis und Infektionen der Atemwege
inkl. Pneumonien verursachen.
Während
Infektionen mit den Genotypen A-K in der Regel auf das
Schleimhautepithel begrenzt sind, können die Genotypen L1, L2 und L3
das Epithel überqueren und invasive Infektionen verursachen, die als
Lymphogranuloma venereum (LGV) bezeichnet werden. LGV-Fälle sind in
Teilen Afrikas, Asiens, Südamerika und der Karibik endemisch. Seit
2003 werden in Europa und Nordamerika vermehrt Fälle von LGV bei
homosexuellen, meist HIV-positiven Männern beobachtet.4
Die einzelnen C. trachomatis Genotypen unterliegen keiner erhöhten
Variabilität. Die intrazelluläre Lebensweise repräsentiert zudem
eine Barriere für genetische Rekombinationen unter verschiedenen
Stämmen. Die Ergebnisse kürzlich durchgeführter
Genom-Sequenzierungen verschiedener C. trachomatis Isolate weisen
aber dennoch auf eine ausgeprägte Rekombinationsaktivität bei C.
trachomatis hin.5
Somit muss davon ausgegangen werden, dass die Infektion von
Wirtszellen mit mehr als einem C. trachomatis Stamm keine Seltenheit
ist. Die Bedeutung genetischer Rekombinationen unter verschiedenen
Stämmen liegt einerseits in der Entstehung neuer Varianten mit
erhöhter Virulenz, wie unlängst für einen LGV Stamm beschrieben,
der aus einer Rekombination von Genotyp D und L2 Stämmen
hervorgegangen ist.6
Darüber hinaus ist das Auftreten genetischer Varianten durch
Rekombination auch für diagnostische Verfahren von Bedeutung,
insbesondere für Verfahren die auf der Detektion von Nukleinsäuren
basieren.
Diagnostik
Die diagnostischen Verfahren zum Nachweis von C. trachomatis Infektionen beinhalten direkte Nachweisverfahren, wie Kultur, Antigentests (EIA, DFA, immunchromatographische Schnelltests), Nukleinsäurehybridisierungs- und Amplifikationstests, sowie indirekte Verfahren mit denen Antikörper gegen C. trachomatis nachgewiesen werden können.
Direkte Nachweisverfahren
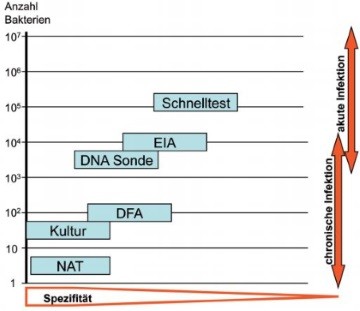
Abb. 2 Analytische Sensitivität und Spezifität der C. trachomatis Nachweisverfahren
Lokale C. trachomatis Infektionen werden üblicherweise durch den direkten Erregernachweis detektiert. Als Methode der Wahl gelten heutzutage Nukleinsäure-Amplifikationstests (NATs), die die Kultur als Gold-Standard in der Chlamydien Diagnostik abgelöst haben.7-9 Die verschiedenen direkten Nachweisverfahren unterscheiden sich hinsichtlich ihrer Sensitivität und Spezifität zum Teil beträchtlich (Abb. 2). Die Anzucht der Chlamydien mittels Zellkultur und die anschließende Identifizierung intrazytoplasmatischer Einschlüsse mit markierten Antikörpern besitzt zwar eine sehr hohe Spezifität, aufgrund der Notwendigkeit vitaler Erreger ist die Sensitivität der Kultur aber begrenzt und liegt bestenfalls bei 60-80%.7 Die höchste Sensitivität haben NATs, mit denen prinzipiell einzelne Erreger nachgewiesen werden können, bei einer Spezifität, die nahezu der der Kultur entspricht (Abb. 2).
Verfahren zum Nachweis von C. trachomatis Antigenen, werden aufgrund unzureichender Sensitivität und Spezifität nicht mehr empfohlen.7,10 Antigen EIAs basieren auf der Verwendung von Antikörpern gegen LPS, die aufgrund von Kreuzreaktionen mit dem LPS apathogener Chlamydien und gram-negativer Bakterien falsch positive Ergebnisse verursachen können.7,10 Der Nachweis von Chlamydien-Antigen mit Fluorescein-markierten monoklonalen Antikörpern (DFA-Test) hat zwar eine höhere Empfindlichkeit, ist aber für die Routine-Diagnostik ungeeignet, da die mikroskopische Untersuchung für größere Probenmengen ungeeignet ist und erfahrenes Personal voraussetzt.7
Schnelltest
Eine Reihe von Chlamydien-Schnelltests beruht ebenfalls auf dem Nachweis von LPS-Antigen, wobei die Detektion meistens durch Immunchromatographie oder optische Interferenz erfolgt. Die einfache Handhabung ohne hohen apparativen Aufwand ermöglicht den Einsatz unabhängig von einem zentralen Labor. Ergebnisse liegen innerhalb von 15-30 Minuten vor, so dass positiv getestete Personen umgehend behandelt werden können und eine Wiedervorstellung nicht erforderlich ist. Diese Tests sind in der Regel aber nicht evaluiert und haben eine im Vergleich zu Kultur und NAT deutliche niedrigere Sensitivität und Spezifität.11-13 Die systematische Evaluierung von Chlamydien Schnelltests im Rahmen des britischen HTA-Programms ergab, dass Schnelltests weder im Screening asymptomatischer Personen noch bei klinischen Verdachtsfällen für die Chlamydien-Diagnostik geeignet sind.11
Nukleinsäureamplifikationstests
C. trachomatis spezifische Nukleinsäuren können durch Hybridisierungs- oder Amplifikationstechniken nachgewiesen werden. Hybridisierungsassays besitzen wie die NATs eine hohe Spezifität, sind diesen aber hinsichtlich der diagnostischen Sensitivität unterlegen.14,15 und werden heute kaum noch eingesetzt. Die für den C. trachomatis Nachweis verwendeten NATs basieren größtenteils auf der Polymerase-Kettenreaktion (PCR). Einzelne kommerzielle Assays verwenden auch das Prinzip der “strand displacement amplification“ (SDA) oder “transcription-mediated amplification“ (TMA). Mehrere kommerzielle Tests ermöglichen gleichzeitig auch den Nachweis von Gonokokken, zum Teil in automatisierten Hochdurchsatzsystemen mit denen über 500 Proben pro Tag gemessen werden können. Seit kurzem ist auch ein molekularer Schnelltest verfügbar, mit dem die Untersuchung einzelner Proben auf Chlamydien und Gonokokken in weniger als 90 Minuten möglich ist. Der Test basiert auf einer real-time PCR in einem geschlossenen System, in dem nach Applikation der Probe in eine Kartusche alle Schritte (Probenextraktion, Amplifikation und Detektion) automatisiert ablaufen.16 Dieser PCR-basierte Schnelltest unterscheidet sich von Antigen-basierten Schnelltests in Bezug auf die diagnostische Genauigkeit und ist den Standard NATs hinsichtlich Sensitivität und Spezifität nicht unterlegen.17
In vielen Studien, in denen C. trachomatis NATs miteinander verglichen wurden, findet sich eine hohe Übereinstimmung der Testergebnisse.18-21 Diskrepante Ergebnisse können aufgrund der unterschiedlichen analytischen Sensitivität der NATs in Proben mit niedriger Erregerkonzentration auftreten.22 Weitere Faktoren, die die Nachweisrate beeinflussen können, sind Sequenzvariationen, das Untersuchungsmaterial und die Extraktionsmethode.23-25
Die im Jahr 2006 in Schweden entdeckte C. trachomatis Variante (E/SW2) enthält eine 377b-Deletion im kryptischen Plasmid, die die Zielregion einiger kommerzieller NATs betraf und von diesen Tests daher nicht erfasst wurde.24 Inzwischen sind diese Tests verbessert worden und verwenden eine andere oder zusätzliche Sequenz als Zielregion, so dass der Nachweis der schwedischen Variante sichergestellt ist.26 Der Nachweis einer zweiten Zielregion in sog. Dual Target Assays hat den Vorteil in Zukunft möglicherweise neu auftretende Varianten zu erfassen, in denen eine der Zielregionen infolge von Deletionen oder Rekombinationen nicht mehr amplifiziert wird.
Untersuchungsmaterial
Grundsätzlich können NAT-Analysen in allen relevanten klinischen Untersuchungsmaterialien durchgeführt werden. Diese beinhalten vor allem Abstrichproben (urethral, zervikal, vulvo-vaginal, anorektal, konjunktival), Urin, Sperma oder Gewebe. Kommerzielle NATs sind für Erststrahlurin, Urethral- und Zervikalabstriche, in einigen Fällen auch für Vaginalabstriche zugelassen. Im Rahmen von Screening-Untersuchungen bei asymptomatischen Personen hat die Analyse nicht-invasiv gewonnener Materialien eine große Bedeutung. Bei Männern sind Chlamydien durch NATs in Erststrahlurin und urethralen Abstrichproben mit ähnlicher Sensitivität nachweisbar, sodass Urinproben als Material der ersten Wahl gelten.7,10,27 Dabei ist es von großer Bedeutung die erste Portion (ca. 20 ml sog. Erststrahlurin) zu verwenden, da die Chlamydien-Konzentration mit zunehmender Urinmenge stark abnimmt.28 Bei Frauen findet sich dagegen eine vergleichsweise höhere Konzentration in Abstrichproben.29 In einer Untersuchung parallel gewonnener Abstriche (vaginal und zervikal) und Urinproben asymptomatischer Frauen war die Nachweisrate mittels NAT bei selbstentnommenen Vaginalabstrichen am höchsten.30 Wie Untersuchungen bei Patienten mit Mycoplasma genitalium Infektion zeigen, kann die Sensitivität durch die Kombination von Zervikal- und Vaginalabstrich noch gesteigert werden.31
Zur Abklärung extragenitaler C. trachomatis Infektionen (Konjunktivitis, anorektale oder pharyngeale Infektionen, inkl. LGV) ist die Untersuchung entsprechender Abstrich- oder Gewebeproben notwendig. Kommerzielle NATs sind dafür zwar nicht zugelassen, mehrere Studien zeigen aber, dass C. trachomatis in diesen Materialien durch NATs mit höherer Sensitivität nachgewiesen werden kann als durch Kultur oder Antigentests32-35, so dass NATs auch bei diesen Fragestellungen zu bevorzugen sind. Die Bestätigung eines LGV erfordert zudem die Identifizierung des Genotyps L1, L2 oder L3, z.B. durch Genotyp-spezifische PCRs, RFLP- oder Sequenzanalyse geeigneter MOMP Genregionen.4,36,37
Müssen positive NAT Ergebnisse bestätigt werden?
Die Notwendigkeit positive NAT-Ergebnisse mit einem zweiten Test zu bestätigen, ist umstritten. Die Empfehlung des CDC zur Durchführung von Bestätigungstests erfolgte um unnötige antibiotische Therapien und psychosoziale Folgen zu minimieren. Aufgrund der hohen Sensitivität der heute verwendeten NATs können aber bei niedriger Erregerkonzentration durchaus unterschiedliche Ergebnisse auftreten, da zufallsbedingt in einzelnen Aliquots die Konzentration unter der Nachweisgrenze liegen kann. Ein nicht bestätigtes positives NAT Ergebnis muss daher nicht unbedingt falsch positiv sein, sondern kann auch ein falsch negatives Ergebnis des Bestätigungstests darstellen.38
Chlamydien-Serologie
Die Untersuchung auf Chlamydien-Antikörper ist bei lokalen oberflächlichen Infektionen des unteren Genitaltrakts ungeeignet, da die Antikörper Antwort in der Regel erst nach mehreren Wochen nachweisbar wird. Zudem ist mit vielen Antikörpertests eine Unterscheidung zwischen den einzelnen Chlamydien-Spezies nicht möglich. Serologische Verfahren können aber zur diagnostischen Abklärung chronisch-invasiver Infektionen (PID, LGV, reaktive Arthritis) herangezogen werden. In diesen Fällen, in denen die Erreger das Epithel überquert haben, liegt in der Regel eine ausgeprägte Immunantwort vor und die Erreger sind in Abstrichproben oftmals nicht mehr nachweisbar. Als Testverfahren werden heutzutage überwiegend EIAs und Immunoblots eingesetzt.39,40 Der Mikroimmunfluoreszenztest (MIFT) galt lange Zeit als Referenzmethode der Chlamydien-Antikörperbestimmung ist aber relativ zeit- und arbeitsaufwändig und hat den Nachteil, dass das Ablesen der Fluorszenzsignale einer subjektiven Bewertung unterliegt.40 Eine Verbesserung der Chlamydien-Serologie wird durch die Verwendung kürzlich identifizierter immunogener Spezies-spezifischer Proteine erwartet.39 Bestimmte Antikörperkonstellationen könnten möglicherweise auch als Marker für das Auftreten chronisch-invasiver Infektionen eingesetzt werden.
Resume
- NATs sind die Methoden der Wahl für den direkten Nachweis von C. trachomatis
- Die Abklärung urogenitaler Infektionen erfolgt bei Männern am besten durch die Untersuchung von Erststrahlurin, bei Frauen sind Abstrichproben (kombinierter Vaginal- und Zervikalabstrich) am besten geeignet
- Bei positiven Befunden ist eine antibiotische Therapie indiziert, die auch alle Sexualpartner einschließen sollte
- Eine Therapieverlaufskontrolle ist in der Regel nicht erforderlich. Sie kommt ggf. bei Infektionen in Schwangerschaft, persistierender Symptomatik oder fraglicher Compliance in Betracht und sollte frühestens 6 Wochen nach Therapiebeginn mit NATs durchgeführt werden
1 Brunham RC, Rey-Ladino J (2005) Immunology of chlamydia infection: implications for a chlamydia tra-chomatis vaccine. Nature Rev Immunol 5:149-161
2 Bandea CI, Kubota K, Brown TM et al. (2001) Typing of Chlamydia trachomatis strains from urine samples by amplification and sequencing the major outer membrane protein gene (omp1). Sex. Transm. Infect. 77:419-422
3 Wright HR, Turner A, Taylor HR (2008) Trachoma. Lancet 371:1945-1954
4 White
JA (2009) Manifestations and management of
lymphogranuloma
venereum. Curr Opin Infect Dis 22:57-66
5 Harris SR, Clarke IN, Seth-Smith HMB (2012) Whole genome analysis of diverse Chlamydia trachomatis strains identifies phylogenetic relationships masked by current clinical typing. Neture Genetics 44:413-420.
6 Samboona N, Wan R, Ojcius DM et al. (2011) Hypervirulent Chlamydia trachomatis clinical strain is a recombinant between lymphogranulkoma venereum (L2) and D lineages.
7 British Association for Sexual Health and HIV (BASHH) (2006) UK national guideline for the management of genital tract infection with Chlamydia trachomatis (www.bashh.org/guidelines)
8 Centers for Disease Control and Prevention (2010) Chlamydial infections 2010 STD treatment guidelines (www.cdc.gov/std/treatment/2010/chlamydial-infections.htm)
9 Scottish Intercollegiate Guidelines Network (SIGN) (2009) Management of genital Chlamydia trachomatis infection. A national clinical guideline (www.sign.ac.uk)
10 Gaydos CA, Quinn TC (2005) Urine nucleic acid ampli-fication tests for the diagnosis of sexually transmitted infections in clinical practice. Curr Opin Infect Dis 18:55-66
11 Hislop J, Quayyum Z, Flett G et al.(2010) Systematic review of the clinical effectiveness and cost-effectiveness of rapid point-of-care tests for the detection of genital chlamydia infection in women and men. Health Technol Assess 14(29)
12 Michel CE, Saison FG, Joshi H et al. (2009) Pitfalls of internet-accessible diagnostic tests: inadequate performance of a CE-marked Chlamydia test for home use. Sex Transm Infect 85:187-189
13 van
Dommelen L, van Tiel FH, Ouburg S et al. (2010) Alarmingly
poor performance in Chlamydia trachomatis
point-of-care
testing. Sex Transm Infect 86:355-359
14 Black CM (1997) Current methods of laboratory diagnosis of Chlamydia trachomatis infections. Clin Microbiol Rev 10:160-184
15 Schachter J, Hook III EW, McCormack WM et al. (1999) Ability of the Digene Hybrid capture II test to identify Chlamydia trachomatis and Neisseria gonorrhoeae in cervical specimens. J Clin Microbiol 37:3668-3671
16 Tabrizi
SN, Unemo M, Golparian D et al. 2013. Analytical evaluation of
GeneXpert CT/NG, the first genetic point-of-care assay for
simultaneous detection of Neisseria gonorrhoeae and Chlamydia
trachomatis.
J Clin Microbiol 51:1945-1947
17 Gaydos CA, van der Pol B, Jett-Gohenn M et al. 2013. Performance of the Cephaid CT/NG Xpert rapid test for detection of Chlamydia trachomatis and Neisseria gonorrhoeae. J Clin Microbiol 51:1666-1672
18 Cook RL, Hutchinson SL, Ostergaard L et al. (2005) systematic review: non-invasive testing for Chlamydia trachomatis and Neisseria gonorrhoeae. Ann Intern Med 142:914-925
19 Marshall R, Chernesky M, Jang D et al. (2007) Characteristics of the m2000 automated sample preparation and multiplex real-time PCR system for detection of Chlamydia trachomatis and Neisseria gonorrhoeae. J Clin Microbiol 45:747-651
20 Gaydos CA, Theodore M, Dalesio N et al. (2004) Comparison of three nucleic acid amplification tests for detection of Chlamydia trachomatis in urine specimens. J Clin Microbiol 42:3041-3045
21 Cheng A, Qian Q, Kirby JE (2011) Evaluation of the Abbott RealTime CT/NG assay in comparison to the Roche Cobas AmplicorCT/NG assay. J Clin Microbiol 49: 1294-1300
22 Chernesky MA, Jang DA, Luinstra K et al. (2006) High analytical sensitivity and low rates of inhibition may contribute to detection of Chlamydia trachomatis in significantly more women by the APTIMA Combo 2 assay. J Clin Microbiol 44:400-405
23 Chernesky MA, Jang DE (2006) APTIMA transcription-mediated amplification assays for Chlamydia trachomatis and Neisseria gonorrhoeae. Expert Rev Mol Diagn 6:519-525
24 Ripa T, Nilsson PA (2007) A Chlamydia trachomatis strain with a 377-bp deletion in the cryptic plasmid causing false negative nucleic acid amplification tests. Sex Transm Dis 34.255-256
25 Skidmore S, Horner P, Herring A et al. (2006) Vulvovaginal swab or first-catch urine specimen to detect Chlamydia trachomatis in women in a community setting? J Clin Microbiol 44:4389-4394
26 Möller JK, Pedersen LN, Persson K (2010) Comparison of the Abbott RealTime CT new formulation assay with two other commercial assays for detection of wild-type and new variant strains of Chlamydia trchomatis. J Clin Microbiol 48:440-443
27 Van der Pol B, Ferrero D, Buck-Barrington L et al (2001) Multicenter evaluation of the BDProbeTec ET system for the detection of Chlamydia trachomatis and Neisseria gonorrhoeae in urine specimens, female endocervical swabs, and male urethral swabs. J Clin Microbiol 39:1008-1016
28 Wisniewski CA, White JA, Michel CE et al. (2008) Optimal method of collection of first-void urine for diagnosis of Chlamydia trachomatis infection in men. J Clin Microbiol. 46:1466-1469.
29 Michel CE, Sonnex C, Carne CA et al. (2007) Chlamydia trachomatis load at matched anatomic sites: implications for screening strategies. J Clin Microbiol 45:1395-1402.
30 Schachter J, McCormack WM, Chernesky MA et al. (2003) Vaginal swabs are appropriate specimens for diagnosis of genital tract infections with Chlamydia trachomatis. J Clin Microbiol 41:3784-3789
31 Lillis RA, Nsuami MJ, Myers L, Martin DH (2011) Utility of urine, vaginal, cervical and rectal specimens for detection of Mycoplasma genitalium in women. J Clin Microbiol 49:1900-1902
32 Schachter J, Moncada J, Liska S et al. (2008) Nucleic acid amplifications tests in the diagnosis of chlamydial and gonococcal infections of the oropharynx and rectum of men who have sex with men. Sex Transm Dis 35:637-642
33 Ota KV, Tamari IE, Smieja M et al. (2009) Detection of Neisseria gonorrhoeae and Chlamydia trachomatis in pharyngeal and rectal specimens using the BD ProbeTec ET system, the Gen-Probe Aptima Combo 2 assay and culture. Sex Transm Infect 85:182-186
34 Hammerschlag MR, Roblin PM Gelling M et al. (1997) Use of polymerase chain reaction tfor the detection of Chlamydia trachomatis in ocular and nasopharyngeal specimens from infants with conjunctivitis. Pediatr Infect Dis J 16.293-297
35 Yang JL, Hong KC, Schachter J et al. (2009) Detection of Chlamydia trachomatis ocular infection in trachoma-endemic communities by rRNA amplification. Investig Ophthalmol Vis Sci 50:90-94
36 Meyer T, Arndt R, von Krosigk A, Plettenberg A (2005). Repeated detection of lymphogranuloma venereum caused by Chlamydia trachomatis L2 in homosexual men in Hamburg. Sex Transm Infect 81:91-92
37 Morre SA, Spaargaren J, Fennema JS et al. (2005) Real- time polymerase chain reaction to diagnose lymphogranuloma venereum. Emerg Infect Dis 11:1311-1312
38 Schachter J, Chow JM, Howard H et al. (2006). Detection of Chlamydia trachomatis by nucleic acid amplification testing: our evaluation suggests that CDC-recommended approaches for confirmatory testing are ill-advised. J Clin Microbiol 44:2512-2517
39 Forsbach Birk V, Simnacher U, Pfrepper KI et al. (2009) Identification and evaluation of a combination of chlamydial antigens to support diagnosis of severe and invasive Chlamydia trachomatis infections. Clin Microbiol Infect 16:1237-1244
40 Morre SA, Munk C, Persson K et al. (2002) Comparison of three commercially available Peptide-based immunoglobulin G (IgG) and IgA assays to microimmunofluorescence assay for detection of Chlamydia trachomatis antibodies. J Clin Microbiol 40:584-587










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
