Truvada® – Zulassung für die PrEP ja, aber mit Auflagen
Truvada
ist international schon länger, in Deutschland erst jetzt zur PrEP
zugelassen. Wie kommt das?
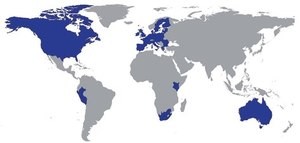
█ Weltweiter Zulassungsstatus Truvada für PrEP
Quelle: Gilead Sciences GmbH, München
Gilead: Es ist zu betonen, dass die Europäische Kommission zwar die Zulassung von Truvada in Kombination mit Safer Sex Praktiken für die Präexpositions-Prophylaxe zur Reduktion des Risikos einer sexuell erworbenen HIV-1-Infek-tion bei Erwachsenen mit hohem HIV-Risiko erteilt hat. Diese Zulassung erfolgte allerdings unter Auflagen. Im Falle von Deutschland ist Truvada nur dann in der Indikation PrEP verkehrsfähig und anwendbar, wenn neben der Fachinformation auch mit der nationalen Zulassungsbehörde abgestimmte Schulungsmaterialien für Verordner und Anwender zur Verfügung stehen. Da diese Materialien zum aktuellen Zeitpunkt noch nicht vorliegen, darf Truvada in Deutschland in der neuen Indikation weder verordnet noch angewendet werden. Gilead befindet sich im engen Abstimmungsprozess mit dem BfArM, um die beauflagten Schulungsmaterialien für Anwender und Ärzte schnellstmöglich zur Verfügung zu stellen.
Die Zulassungseinreichung in Europa war das Ergebnis eines langen Prozesses: Das Unternehmen stand bereits seit 2011 in engem Austausch mit der europäischen Zulassungsbehörde. Die Antragstellung erfolgte nun nach umfangreichen Diskussionen und aufgrund einer zunehmenden Evidenzbasis.
PrEP erfordert viel Aufklärung. Wie wird Gilead hier die Ärzte unterstützen?
Gilead: Wie bereits erläutert wird es im Rahmen der Zulassung umfangreiche Schulungsmaterialien für Ärzte und Anwender geben, die sehr genau über die richtige Initiierung, Sicherheitsaspekte und Einnahme sowie weiteres Monitoring informieren werden.
Falls es darüber hinaus noch weiterführende oder individuelle Fragen gibt, können Ärzte wie bereits auch in der Vergangenheit jederzeit auf unseren MedInfo Service zurück greifen.
In den USA gibt es Implementierungsstudien und Programme zur PrEP. Werden Sie sich hier in Deutschland engagieren, solche Aktivitäten finanziell unterstützen?
Gilead: Es ist korrekt, im gesamten Gebiet der USA hat Gilead mit Bundes-, Landes- und lokalen Gesundheitsbehörden und Interessenverbänden zusammengearbeitet, um PrEP-Initiativen zu implementieren, z.B. Input des Unternehmens für Leitlinien zur Anwendung und für Umsetzungspläne von Gesundheitsbehörden. Die Gesundheitssysteme in Deutschland und den USA sind jedoch sehr unterschiedlich. Erfolgreiche Programme in einem Land oder einer Region sind nicht unbedingt die beste Lösung für ein anderes Land. In Deutschland fokussieren wir uns derzeit vollkommen auf die Freigabe der Schulungsmaterialien und die Zusammenarbeit mit dem BfArM, um Truvada für PrEP zeitnah in Verkehr bringen zu können.
Wenn Truvada zur PrEP zugelassen ist, ist es dann automatisch erstattungsfähig? Müssen die Krankenkassen die Kosten übernehmen?
Gilead: Die Zulassung einer neuen Indikation im Bereich der Prävention für eine etablierte HIV-1-Behandlung stellt eine einzigartige Situation für viele nationale Erstattungsinstanzen dar. In Deutschland ist der Einsatz von Truvada zur PrEP als Primärpräventionsmaßnahme definiert und damit durch den Leistungskatalog der gesetzlichen Krankenversicherungen nach derzeitiger Rechtslage nicht abgedeckt. Die Entscheidung über einen potentiellen Verordnungseinschluss obliegt allein dem G-BA.
Wird Truvada zur PrEP den AMNOG-Prozess durchlaufen?
Gilead: Als Bestandsmarkt-Produkt (eingeführt vor dem 1. Januar 2011) unterliegen Truvada und Zulassungserweiterungen für Truvada nicht dem AMNOG.
Derzeit beträgt der Preis für 30 Tabletten Truvada rund 800,- €. Wird sich der Preis in absehbarer Zeit ändern?
Gilead: Truvada ist seit 2005 für die Behandlung der HIV-1-Infektion bei Erwachsenen verfügbar. Grundsätzlich hat die Erweiterung der Zulassung keinen Einfluss auf den Preis von Truvada. Unterschiedliche Preise für unterschiedliche Teilindikationen eines Produktes sind im deutschen System nicht vorgesehen und auch nicht umsetzbar.
Wird es neue Packungsgrößen mit weniger Tabletten geben? Neue Verpackungen?
Gilead: Gemäß beantragter Zulassungserweiterung muss die Einnahme von Truvada für die PrEP kontinuierlich einmal täglich erfolgen – eine „on demand“-Einnahme wäre damit außerhalb des Labels. Vor diesem Hintergrund ist eine kleinere Packungsgröße nicht umsetzbar.
Denken wir etwas voraus. Wird TAF auch zur PrEP weiter entwickelt?
Gilead: Eine Phase-III-Studie, die den Einsatz von Descovy® (Emtricitabin [FTC] / Tenofoviralafenamid [TAF]) für die PrEP untersucht, wird Ende 2016 mit der Rekrutierung der Teilnehmer beginnen. Auf der Basis der Ergebnisse wird dann eine Entscheidung über eine Einreichung zur Zulassung getroffen werden.
2017 läuft das Patent von Viread® (Tenofovirdisoproxilfumarat) aus. Wie sieht es mit Truvada aus? Wird Gilead – wie viele anderen Firmen – nach Ablauf des Patents selbst Generika produzieren bzw. mit Generika-Herstellern kooperieren?
Gilead: Wir rechnen mit dem Launch von Generika nach dem Patentauslauf von Truvada in Europa im 3. Quartal 2017. Hersteller, die Truvada als Generikum auf den Markt bringen, erhalten die gleiche Indikation wie das Originalpräparat. Zu möglichen Kooperationen mit Generikaherstellern in Europa können wir derzeit noch nichts sagen.
Was viele vermutlich noch nicht wissen: Weltweit arbeitet Gilead schon jetzt mit 21 Generika-Herstellern in Indien, China und Süd-Afrika zusammen, um sowohl unsere TDF als auch TAF-haltigen Regime in Entwicklungs- und Schwellenländern bereitzustellen. Generikahersteller produzieren derzeit ca. 98% der Gilead HIV Medikamente, die in Entwicklungsländern verordnet werden. Durch den Wettbewerb der lizensierten Generikahersteller sind dort die Kosten für Gilead HIV-Medikamente um etwa 80% gefallen.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
