Dirk Berzow, Hamburg, und Josef Eberle, München
HIV-2: Selten und anders, aber nicht harmlos
Selbst HIV-Spezialisten haben nur selten mit HIV-2 zu tun, denn im Vergleich mit HIV-1 ist diese Infektion in Deutschland fast 1.000-mal seltener. Das Robert Koch-Institut rechnet mit ca. 100 HIV-2 Infizierten (mündliche Mitteilung, Ulrich Markus, RKI). Die Zahl der HIV-1 und HIV-2 doppelinfizierten Personen ist noch geringer anzusetzen. 2016 wurden dem RKI 13 neue HIV-2 Mono-Infektionen und 5 Doppelinfektionen gemeldet. In Österreich sind 7 Fälle gemeldet. Entsprechend gering ist die Verbreitung des Spezialwissens bei der Diagnostik und der Therapie dieser Infektion.
Ursprung und Verbreitung
HIV-2 stammt von SIVsm ab, einem Primatenvirus, das mit seiner Wirtsspezies, der Rauchgrauen Mangabe (sooty mangabey), in einer sehr langen gemeinsamen Evolution verbunden ist und daher für seinen Wirt apathogen ist. Aus diesem Viruspool in Westafrika wurde es in der ersten Hälfte des 20. Jahrhunderts mindestens neunmal auf die menschliche Spezies übertragen (Gruppen A-I). Doch nur Infektionen mit den HIV-2 Gruppen A und B sowie deren Rekombinanten scheinen für den Menschen pathogen zu sein (Visseaux 2016) und haben zu einer endemischen Ausbreitung bei Menschen in Westafrika geführt (Abb. 1 und 2).
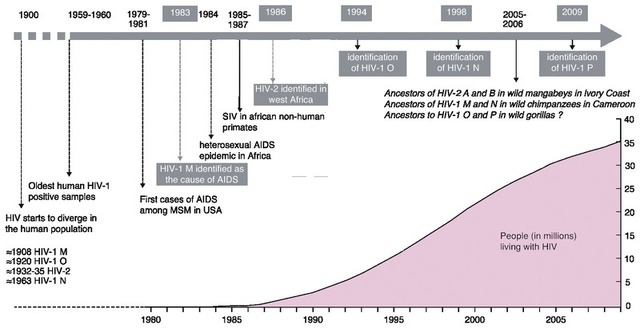
Abb.
1 Geschichte der AIDS-Pandemie – Rekonstruktion des zeitlichen
Verlaufs der speziesüber - schreitenden Infektionen von
Primatenretroviren auf den Menschen (modifiziert nach Locatelli 2012)
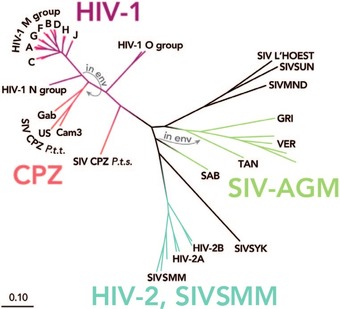
Abb. 2 Verwandschaftsbeziehungen zwischen HIV-1, HIV-2 und anderen Primatenretroviren
Quelle: Menendez-Ariaz 2014
Die
hauptsächlich betroffenen Länder mit einer Prävalenz über 1% sind
Senegal, Gambia, Guinea-Bissau, Elfenbeinküste und Sierra Leone.
Die höchste Prävalenz wurde aus Guinea-Bissau in den 90er-Jahren
berichtet (8,3%), interessanterweise mit einem Abfall bis 2007 (4,7%)
und gleichzeitigem Anstieg der HIV-1 Prävalenz von 0,1% auf 3,6 %
(van Thienen). Weitere Länder mit einer relevanten Zahl von HIV-2
Infizierten in Westafrika sind die Kapverdischen Inseln, Guinea,
Mali, Burkina Faso, Ghana, Togo, Benin, Nigeria, Kamerun und einige
Länder mit ehemals kolonialen Beziehungen zu Westafrika (Angola,
Mozambique, Goa-Region in Indien) (Abb. 3). In Europa leben die
meisten Menschen mit einer bekannten HIV-2 Infektion in Frankreich
(1.091 Patienten in der ARNS-Kohorte) und Portugal (1.813 kumulative
Meldungen).
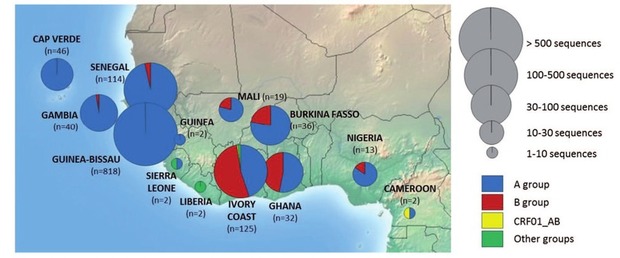
Abb. 3 Verteilung von HIV-2 Gruppen in Westafrika (Auswertung von analysierten Gensequenzen, Los Alamos National Laboratory database) n = Anzahl der Viren, für die eine Sequenzierung vorliegt
© Visseaux B, Infect Genet Evol. 2016 Dec
Suchtest
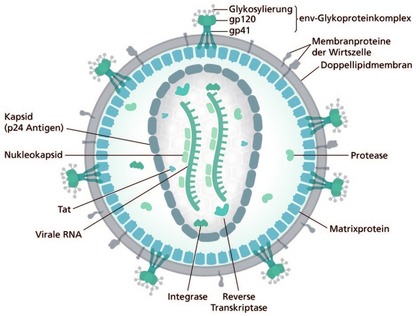
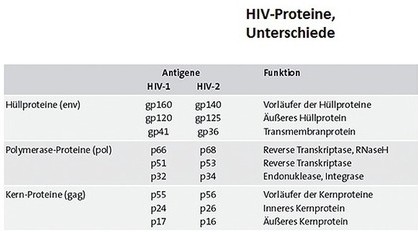
Abb. 4 Unterschiede HIV-1 und HIV-2 – HIV-Proteine, drei funktionelle Gruppen
Für die korrekte Diagnose, Therapieindikation und -überwachung gibt es einige Unterschiede zu HIV-1, die es zu beachten gilt. HIV-2 Infizierte werden von den heute üblichen Labortests der 4. Gene-ration (simultaner Nachweis von HIV-1/-2 Antikörpern und HIV-1 p24 Antigen) zuverlässig erfasst. Allerdings kann die Fensterphase zwischen Ansteckung und Serokonversion um wenige Wochen länger ausfallen, da für den Antigennachweis eine geringere Sensitivität anzunehmen ist. Gründe dafür sind die bei HIV-2 generell niedrigeren Viruslasten und der Umstand, dass die Tests auf die Erkennung von HIV-1 p24 optimiert sind und somit das analoge HIV-2 p26 schlechter erfasst wird (Abb. 4).
Bestätigungstest
Die serologische Unterscheidung zwischen HIV-1 und HIV-2 bzw. einer Doppelinfektion mittels Immunoblotverfahren ist nicht immer einfach und sollte im Zweifel in spezialisierten, erfahrenen Laboren erfolgen.
Viruslast
Da im Unterschied zu HIV-1 bei HIV-2 ein beträchtlicher Anteil der nicht therapierten Infizierten keine nachweisbare Viruslast aufweist, ist dieser Test für eine Bestätigung der HIV-2 Diagnose nur bei positivem Ergebnis aussagekräftig. Gründe für die häufig negativen Ergebnisse sind die oben erwähnte oft geringere Viruslast und ein hohe genetische Variabilität der HIV-2 Gruppen, so dass auch mit falsch-negativen Ergebnissen zu rechnen ist. Bei verdächtigem Bestätigungstest im Sinne einer Doppelinfektion und negativer HIV-2 RNA-Last kann daher eine Testung auf provirale HIV-2 DNA aus EDTA-Blut zur Klärung hilfreich sein. Die HIV-2 Plasma-RNA hat ihren Stellenwert daher nicht bei der Diagnostik, sondern beim Monitoring der Infektion.
Resistenztest
Bei nachweisbarer Viruslast, unabhängig von der Höhe, sollte eine Resistenztestung für die virale Protease, Reverse Transkriptase und Integrase angestrebt werden. Übertragene Resistenzen sind bisher selten (Charpentier 2013). Bei Bedarf steht auch eine validierte Testung auf den Virustropismus zur Verfügung (www.HIV-GRADE.de, Geno2pheno [coreceptor-hiv2], Döring).
Wann an HIV-2 denken?
Fallbericht
Bei
einem Patienten aus Senegal wurde eine HIV-1 Infektion in
fortgeschrittenem Stadium diagnostiziert und antiretroviral
behandelt. Es gelang, die Viruslast dauerhaft unter die
Nachweisgrenze zu drücken.
Aufgrund von Nebenwirkungen
wurde die Therapie mehrfach umgestellt, teilweise mit NRTIs in
Kombinationen mit NNRTIs oder PIs. Obwohl die
Viruslast des Patienten zuletzt 10 Jahre
nicht nachweisbar war, sanken seine CD4 Zellen auf zuletzt 60/µl.
Eine intensivere Ursachensuche erbrachte Hinweise auf eine
Koinfektion mit HIV-2 mit hohen Viruslasten, einer komplizierten
Resistenz gegen alle NRTIs und teilweise gegen
PIs. Glücklicherweise konnte unter einer Kombination wirksam
verbliebe-
ner Substanzen und dem Einsatz eines InSTI die HIV-2
Replikation gestoppt werden (Veröffentlichung: Taylor et al., 2014).
Bei Menschen mit Risikofaktoren für eine HIV-Infektion, die aus westafrikanischen Ländern oder Ländern mit relevantem Vorkommen von HIV-2 stammen (s.o.), oder die Sexualkontakte zu Menschen haben, die HIV-2 infiziert sein könnten, sollte besonders sorgfältig auf HIV-2 getestet werden. Wenn bei der Bestätigung eines reaktiven HIV-Suchtests die HIV-1 Viruslasttestung negativ ausfällt, sollte immer eine weitere Bestätigung mittels Immunoblot erfolgen. Im Fall einer Doppelreaktivität im Bestätigungstest ist eine weitere Abklärung, ob eine Doppelinfektion vorliegt, anzustreben (s.o.). Dies wurde in der Vergangenheit nicht immer so systematisch gehandhabt. Daher sind Angaben zu Doppelinfektionen schwer einzuordnen und zu vergleichen. Doppelinfektionen sind eher seltener als HIV-2 Monoinfektionen.
Klinisches Bild
Grundsätzlich unterscheidet sich die Klinik der HIV-2 Infektion nicht von der der HIV-1 Infektion. Schon bei der Erstbeschreibung 1986 war klar, dass HIV-2 zu AIDS und Tod führen kann (Clavel), obwohl HIV-2 Infizierte im Durchschnitt höhere CD4-Zellzahlen und eine niedrige Plasmavirämie haben (Popper). Die Infektion scheint im Allgemeinen „milder“ zu verlaufen (Marlink). Charakteristika der HIV-2 Infektion sind:
- Viele Patienten zeigen auch unbehandelt keine Zeichen von AIDS (Berry).
- Die Mortalität von HIV-2 Monoinfizierten ist niedriger als die von HIV-1 Monoinfizierten und HIV-1/HIV-2 Doppelt-Infizierten, aber höher als die von HIV-Negativen (Schim von der Loeff, Prince).
- Viele HIV-2 Infizierte haben keine nachweisbare Plasma-Viruslast (Matheron 2003).
- Wenn eine Plasma-Viruslast nachweisbar ist, ist sie deutlich (30-100-mal) niedriger (Matheron 2003).
- In Kohorten zeigen HIV-2 Patienten im Schnitt höhere CD4-Zellzahlen und der Abfall der CD4-Zellzahlen über die Jahre ist langsamer (Drylewicz).
Aber:
- Die Menge der Proviralen DNA ist bei HIV-1 und HIV-2 gleich (MacNeil).
- Patienten mit nachweisbarer oder gar hoher Viruslast zeigen eine Krankheitsprogression (Hansmann, Matheron). Die Krankheitsprogression zu AIDS kann dann schnell verlaufen („rapid progressors“).
- Ein Teil der HIV-2 Patienten zeigen einen CD4-Abfall trotz nicht nachweisbarer Plasma-Virämie.
- Bei hohen Viruslasten (>10.000 Kopien/ml) zeigen HIV-2 Infizierte eine höhere Mortalität als HIV-1 Infizierte (Hansmann).
HIV-2 Patienten können generell in „Progressors“ und „Non-Progressors“ eingeteilt werden. Möglicherweise ist aber die Krankheitsprogression bei der HIV-2 Infektion nur langsamer.
Die Einschätzung, wie groß der Anteil der „Non-Progressors“ ist, hat sich im Laufe der Jahre geändert. In den ersten Jahren der Beobachtung schienen 80-90% der Infizierten „Non-Progressors“ zu sein (Schim van der Loeff, Matheron), 2011 waren in der französischen HIV-2 Kohorte 6,1% der Patienten „Long-Term-Non-Progressors“ (LTNP) und 1,9% „Elite-Controllers” (EC). Das Auftreten von LTNP und EC war also 10-40-mal häufiger als in vergleichbaren HIV-1 Kohorten, aber die restlichen Patienten waren keine „Non-Progressors“.
2017
berichtet Esbjörnson von einer kleinen Kohorte (zu Beginn 225 HIV-1
und 87 HIV-2 positive Teilnehmer) in Guinea-Bissau, dass in der
Beobachtungszeit von 20 Jahren die durchschnittliche Zeit bis zum
Ereignis AIDS und Tod in der HIV-1 Gruppe 6,2 und 8,2 Jahre und in
der HIV-2 Gruppe 14,3 und 15,6 Jahre dauerte. Der durchschnittliche
Abfall der CD-4 Zellzahl pro Jahr war 22,3 pro µL bei HIV-1 und 11,8
pro µL bei HIV-2. Bei HIV-2 Patienten trat AIDS bei einer
höheren
durchschnittlichen CD-4 Zellzahl auf: 237 cells/mm3
(HIV-2) vs. 137 cells/mm3
(HIV-1).
Transmission
Die heterosexuelle Transmissionsrate von HIV-2 ist geringer als die von HIV-1. In einer prospektiven Studie mit einer Kohorte (Sex Workers, Senegal) war die Transmission von HIV-2 im Vergleich zu HIV-1 3,6-mal niedriger (Gilbert). In einer Untersuchung, ebenfalls in Senegal, fand sich deutlich weniger HIV-2 RNA in Samenflüssigkeit von HIV-2 Probanden (2,6 log10 cp/ml vs. 4.4 log10 cp/ml bei HIV-1, Gottlieb).
Die vertikale Transmission ist ebenfalls geringer. In einer Studie aus Gambia war die Mother-To-Child-Transmission 4% bei HIV-2 vs. 24% bei HIV-1 (Ota 2000) (mittlere Viruslast der Mütter VL 410 cp/ml vs. 15.000 cp/ml). In der französischen HIV-2 Kohorte kam es bei 223 Geburten zu 2 Übertragungen von HIV-2 auf Kinder (14% der Frauen waren unter ART vor und 57% während Schwangerschaft, in 68% kam es zu vaginalen Entbindungen). In dem einen Fall handelte es sich um eine primäre Infektion kurz vor der Entbindung, im anderen Fall wird eine postnatale Infektion durch Stillen (bei Virämie der Mutter, ohne ART, Lost-To-Follow-Up) vermutet (Burgard).
Von HIV-2 lernen?
Der große Anteil von „Non-Progressors“, LTNP und EC und der in vielen Fällen „mildere“ Verlauf der HIV-2 Infektion haben immer wieder das Interesse der Forscher geweckt. Es gibt einige Unterschiede im Genom von HIV-1 und HIV-2 (Übereinstimmung auf Aminosäurenebene nur 40% in der env-Region, 60% in den pol- und gag-Regionen, weiterhin Unterschiede in der Funktion der nef-, tat-, vpx-, und vpu-Gene).
Ist HIV-2 ein „attenuiertes“ Virus? Bei gleicher Menge proviraler DNA ist die Virusreplikation geringer und die RNA-Transkription scheint blockiert zu sein (MacNeil 2007).
Welche Wirtsfaktoren sind für den unterschiedlichen Verlauf verantwortlich? Viele Patienten zeigen weniger Veränderungen der CD4- und CD8-Zellfunktionalität, weniger Immunaktivierung, weniger Zellapoptose, bessere neutralisierende Antikörper und beispielsweise Unterschiede bei SAMHD1, TRIM5a, Tetherin und NK-Zellen. Liegt hier der Schlüssel? Bisher lässt sich kein einheitliches Gesamtbild zusammenfügen, das die bestehenden Fragen befriedigend erklären kann (Reviews: de Silva 2008, Nyamweya 2013).
Therapie
Alle antiretroviralen Medikamente sind v.a. gegen HIV-1 Subtyp B entwickelt worden. Leider ist die Wirksamkeit dieser Substanzen gegen HIV-2 teilweise drastisch eingeschränkt. Ein Teil der Therapieempfehlungen basiert immer noch auf in-vitro-Daten. Keines der empfohlenen Medikamente ist in randomisierten Studien getestet worden.
Wirksam gegen HIV-2 sind:
- Nukleos(t)idische Reverse Transkriptase Inhibitoren (NRTI): Abacavir (ABC), Lamivudin (3TC), Emtricita-bine (FTC), Tenofovir (TDF/TAF) und Ziduvudin (AZT)
- Drei Substanzen aus der Gruppe der Protease-Inhibitoren(PI): Lopinavir (LPR), Darunavir (DRV) und Saquinavir (SQV)
- Integrase-Inhibitoren (InSTI): Raltegravir (RAL), Elvitegravir (EVG) und Dolutegravir (DTG)
- Bei CCR5-Tropismus Korezeptor-Antagonisten: Maraviroc (MVC)
Nicht wirksam gegen HIV-2 sind:
- Nicht-Nukleosidische Reverse-Trans-kriptase-Inhibitoren (NNRTI): Alle (intrinsische Klassen-Resistenz)
- Fusionsinhibitoren: Enfuvirtide
Bis jetzt liegen Therapie-Guidelines aus Großbritannien (Gilleece 2010), USA (Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents. HIV-2 Infection, 2015), und Frankreich (Infection VIH-2; Diversité des VIH-1 (septembre 2016), Conseil national du SIDA 2016; http://cns.sante.fr/wp-content/uploads/2017/) vor. Ein Entwurf für europäische Guidelines für Diagnostik und Therapie der HIV-2 Infektion wird zur Zeit von der HIV-2EU Group ausgearbeitet.
Therapiebeginn
Der
Start der ART muss kritisch erwogen werden. Die Empfehlungen bei
HIV-2 sind konservativer als bei HIV-1. „NonProgressors“ sollten
nicht behandelt werden. Das Argument „Treatment as Prevention“
wird von Experten nicht so stark gewichtet, da die Transmissionsraten
geringer sind, das Arsenal der Medikamente im Vergleich zu HIV-1
begrenzt ist und die verbleibenden NRTI und PI weniger robust zu
sein scheinen.
Französische Leitlinien
empfehlen Therapiestart bei:
- jedem symptomatischen Patienten (CDC-Klassifikation Stadium B oder C).
Eine Therapie ist zu erwägen bei
- Abfall der CD4-Zellzahlen unter 500 pro µL,
- Abfall der CD4-Zellzahlen ≥30 c/µL pro Jahr (an mehreren aufeinander folgenden Jahren),
- wiederholt nachweisbarer HIV-2 Plasma-RNA (diese Patienten sind „Progressors“),
- Patienten mit Komorbiditäten wie HBV, HCV, Tb,
- und Schwangeren.
Nicht behandelt werden brauchen
LTNP und EC mit CD4-Zellzahlen über 500 pro µL und nicht nachweisbarer Plasma-Viruslast.
Nach Beginn der ART ist der Wiederanstieg der CD-4 Zellzahl deutlich geringer und langsamer (Drylewicz). AIDS kann bei HIV-2 schon bei höheren CD4-Zellzahlen auftreten (Esbjörnson). Deshalb sollte die Therapie auch nicht zu spät eingeleitet werden.
Eine Firstline-Therapie sollte aus einem Kombi-Präparat aus 2 NRTI (Truvada, Descovy, Kivexa) und einem dritten Kombinationspartner aus der Gruppe der wirksamen PI (DRV oder LPV geboostet) oder einem InSTI (RAL, EVG oder DTG) bestehen. Eine Triple-NRTI Behandlung wird nicht mehr empfohlen (Benard, Balestre).
Therapieverlauf
Das Therapiemonitoring sollte engmaschig genug erfolgen, so dass ein ausbleibender Therapieerfolg schnell erkannt wird. Eine Umstellung der Therapie sollte nach Resistenztest und möglicherweise Tropismustest mit verbleibenden aktiven Substanzen erfolgen (z.B. 2 NRTI und Wechsel des dritten Partners von PI auf InSTI oder vice versa), AZT, SQV und MVC sind je nach Resistenz- und Tropismus-Testung geeignete Reservemedikamente.
Resistenzbildung

sooty mangabey
©Yerkes NPRC. Daily, the diurnal sooty mangabey.
Zahlreiche Polymorphismen (natürlich vorkommende Abweichungen der Aminosäurensequenz von HIV-2 gegenüber HIV-1) kommen auch an Schlüsselstellen für die Ansatzpunkte der antiretroviralen Medikamente vor. Sie spielen wahrscheinlich eine Rolle bei der Unwirksamkeit einiger Substanzen und bei der relativ schnellen und anders ablaufenden Resistenzbildung bei den NRTI und PI. Die häufigsten Resistenzen bei NRTI sind M184V, K65R, Q151M, seltener S215A/C/F/L/Y. Die häufigsten Mutationen bei PI sind G38V, V47A, I54M, I82F, I84V und L90M. Bei PI reichen schon ein bis zwei Mutationen zur teilweisen oder vollständigen Resistenz. Integrase-Inhibitor Mutationen scheinen dasselbe Muster wie bei HIV-1 zu zeigen (Camacho, Charpentier 2015, Menendez-Arias). Eine Liste von HIV-2 Resis-tenz-assoziierten Mutationen ist von der HIV-2EU Group erarbeitet worden (Charpentier 2015) und liegt bei HIV-GRADE als HIV-2EU Tool zum Gebrauch per Internet vor (http://www.hiv-grade.de/cms/grade/homepage/).
Obwohl eine HIV-2 Infektion im deutschen Sprachraum nicht häufig vorkommt, ist es trotzdem ratsam, bei diesen Patienten die Besonderheiten zu beachten und Fallstricke in Diagnostik und Therapie zu vermeiden. Es ist zu hoffen, dass in Zukunft mehr Studien (auch in den ressourcenarmen Ländern) zu HIV-2 ermöglicht werden, wie es schon seit 2008 von HIV-2 Experten gefordert wird (Gottlieb 2008).
Literatur
Balestre E, Ekoue D, Tchounga B. Immunologic res-ponse in treatment-naı¨ve HIV-2-infected patients: the IeDEA West Africa cohort. Journal of the International AIDS Society 2016, 19:20044.
Benard A, van Sighem A, Taieb A, et al. Immunovirological response to triple nucleotide reverse-trans-criptase inhibitors and ritonavir-boosted protease inhibitors in treatment-naive HIV-2-infected patients: The ACHIEV2E Collaboration Study Group. CID 2011, 52: 1257-1266.
Berry N, Jaffar S, Schim van der Loeff M et al, Low Level Viremia and High CD4% Predict Normal Survival in a Cohort of HIV-2Infected Villagers. AIDS Res Hum Retroviruses 2002, 18:1167-73.
Burgard M, Jasseron C, Matheron S, et al. Mother-to-Child Transmission of HIV-2 Infection from 1986 to 2007 in the ANRS French Perinatal Cohort EPF-CO1. CID 2010, 51:833-843.
Camacho R. Special aspects of the treatment of HIV-2-infected patients.. Intervirology 2012; 55: 179-183.
Charpentier C, Visseaux B, Bénard A, et al. Transmitted drug resistance in French HIV-2-infected patients. AIDS 2013, 27:1671-4.
Charpentier C, Camacho R, Ruelle J et al, HIV-2EU-Supporting Standardized HIV-2 Drug-Resistance Interpretation in Europe: An Update. Clin Infect Dis 2015;61:1346-7.
Clavel F, Guyader M, Guetard D et al. Molecular cloning and polymorphism of the human immune deficiency virus type 2. Nature 1986b Vol. 324:691.
de Silva T, Cotton M, Rowland-Jones. HIV-2: The forgotten AIDS virus. Trend in Microbiology 2008, 16(12):588-95.
Döring M, Borrego P,Buech J et al. A genotypic method for determining HIV-2 coreceptor usage enables epidemiological studies and clinical decision support. Retrovirology (2016) 13:85 DOI 10.1186/s12977-016-0320-7.
Drylewicz J, Matheron S, Lazaro E, et al. Comparision of viro-immunological marker changes between HIV-1 and HIV-2 infected patients in France AIDS 2008, 22: 457-68.
Ekouevi DK, Tchounga BK, Coffie PA, et al. Antiretroviral therapy response among HIV-2 infected patients: a systematic review. BMC Infect Dis 2014, 14:461.
Esbjörnson J, Mansson F, Kvist A, High rate of disease progression in untreated HIV-2 infection, CROI 2017 Abstract No 37
Gilbert PB, McKeague IW, Eisen G, et al. Comparison of HIV-1 and HIV-2 infectivity from a prospective cohort study in Senegal. Stat Med 2003, 22:573-93
Gottlieb GS, Hawes SE, Agne HD, et al. Lower levels of HIV RNA in semen in HIV-2 compared with HIV-1 infection: implications for differences in transmission. AIDS 2006; 20:895-900.
Gottlieb S, Eholie S, Nkengaong. A Call for Randomized Controlled Trials of Antiretroviral Therapy for HIV-2 Infection in West Africa. AIDS 2008 22(16), 2069-2074.
Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents. HIV-Infection 2015. aidsinfo.nih.gov/guidelines/html/1/adult-and-adolescent-arv-guidelines/24/hiv-2-infection.
Hansmann A, Schim van der Loeff MF, et al. Baseline plasma viral load and CD4 cell percentage predict survival in HIV-1- and HIV-2-infected women in a community-based cohort in The Gambia. JAIDS 2005; 38:335-341.
Infection VIH-2; Diversité des VIH-1 (septembre 2016) Groupe d’experts pour la prise en charge du VIH. Conseil national du SIDA. cns.sante.fr/wp-content/uploads/2017/
Locatelli S, Peeters M. 2012, Cross-species transmission of simian retroviruses: how and why they could lead to the emergence of new diseases in the human population. AIDS 26 (6), 659-673 (2012).
MacNeil A, Sarr A, Sakale J, et al. Direct evidence of lower viral replication rates in vivo in human immunodeficiency virus type 2 (HIV-2) infection than in HIV-1 infection. J Virol 2007, 81:5325-30.
Marlink R, Kanki P, Thior I et al. Reduced Rate of Disease Development After HIV-2 Infection as Compared to HIV-1. Science 1994, 265:1587-1590.
Matheron S, Pueyo S, Damond F, et al. Factors associated with clinical progression in HIV-2 patients: The French ARNS cohort. AIDS 2003, 17;2593-2601.
Menendez-Ariaz M, Alvarez M. Antiviral therapy and drug resistance in human immunodeficiency virus type 2 infection, Antivir Res 2014; 102:70-86.
Nyamweya S, Hegedus A, Jaye A, et al. Comparing HIV-1 and HIV-2 infection: Lessons for viral immunopatogenesis. Rev Med Virol 2013; 23:221-240.
Ota M, O‘Donovan D, Alabi A, et al. Maternal HIV-1 and HIV-2 infection and child survival in The Gambia. AIDS 2000, 14:435-9.
Popper S, Sarr A, Travers K, et al. Lower Human Immunodeficiency Virus (HIV) Type 2 viral load reflects the difference in pathogenicity of HIV-1 and HIV-2. J Infect Dis 1999;180:1116-21.
Prince P, Matser A, van Tienen C, et al, Mortality rates in people dually infected with HIV-1/2 and those infected with either HIV-1 or HIV-2: a systematic review and meta-analysis. AIDS 2014, 28:549-58.
Schim van der Loeff MF1, Larke N, Kaye S, et al,Undetectable plasma viral load predicts normal survival in HIV-2-infected people in a West African village. Retrovirology. 2010 May 19;7:46.
Taylor N, Kern JM, Prammer W, et al. Human immunodeficiency virus type 2 infections in Austria. Wien Klin Wochenschr. 2014 Apr;126(7-8): 212-6. doi: 10.1007/s00508-013-0493-1. Epub 2014 Jan 18.
Thiebault R Matheron S, Taieb A, et al, Long-term nonprogressors and elite controllers in the ARNS CO5 HIV-2 cohort. AIDS 2011, 25:865-867.
van Tienen C, van der Loeff M, Zaman S, et al. Two destinct epidemics: the rise of HIV-1 and decline of HIV-2 infection between 1990 and 2007 in rural Guinea-Bissau. JAIDS 2010; 53:640-7.
Visseaux B, Damond F, Matheron S et al. Hiv-2 molecular epidemiology. Infection, Genetics and Evolution 46 (2016) 233-240.











 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
