Stefan Esser, Christian Hoffmann, Franz Mosthaf und Michael Sabranski
Kaposi-Sarkom
Das Kaposi-Sarkom (KS) entstammt am ehesten lymphatischen endothelialen Zellen, deren maligne Transformation durch eine Infektion mit dem Humanen Herpesvirus 8 (HHV8) mit verursacht wird. Immunsuppression begünstigt das Auftreten, die Persistenz und die Progredienz von Kaposi-Sarkomen.
Einteilung
Das klassische Kaposi-Sarkom betrifft in erster Linie ältere Männer aus dem osteuropäisch-mediterranen Bereich oder jüdischer Herkunft mit einem Altersgipfel im 7. Lebensjahrzehnt. Beim endemischen Kaposi-Sarkom im südlichen Afrika, das nicht mit einer HIV-Infektion assoziiert ist, unterscheidet man vier klinische Verlaufsformen:
- Relativ gutartige noduläre Hautveränderungen, ähnlich denen beim klassischen Kaposi-Sarkom. Aggressiv lokalisiert kutane Verlaufsform mit Infiltration in Weichteilgewebe und Knochen
- Diffus mukokutaner Befall und viszeraler Befall
- Fulminant verlaufend: Lymphadenopathie und Beteiligung der viszeralen Organe in der Regel ohne Hautbeteiligung, vor allem auftretend bei Kleinkindern.
Das iatrogen immunsuppressiv bedingte Kaposi-Sarkom kann sowohl chronisch als auch schnell progredient sein. In der Regel kommt es nach Beendigung der immunsuppressiven Therapie zur Remission.
KS und Aids
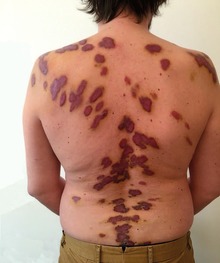
Abb. 1 Aids-assoziiertes Kaposi-Sarkom am Rücken
Das Aids-assoziierte Kaposi-Sarkom ist als Folge der effektiven antiretroviralen Therapie der HIV-Infektion mittlerweile deutlich zurückgegangen. Dennoch stellt dieser Tumor nach wie vor das häufigste AIDS-assoziierte Malignom dar. Das Risiko eines HIV-Patienten, an einem Kaposi-Sarkom zu erkranken, ist im Vergleich zur Normalbevölkerung 20.000fach und im Vergleich zu anderen immunsupprimierten Patienten 300fach erhöht. Auch innerhalb der verschiedenen HIV-Transmissionsgruppen ist das Risiko unterschiedlich verteilt: Homosexuelle Männer haben ein 20fach höheres Risiko als Hämophile und bei Frauen tritt das Kaposi-Sarkom selten auf. In den letzten Jahren werden vermehrt HIV-assoziierte Kaposi-Sarkome auch bei Patienten mit höheren Helferzellzahlen und niedriger HIV-Viruslast beobachtet und zwar auch bei Patienten unter einer erfolgreichen cART (combination antiretroviral therapy).
Klinisches Bild
Das Kaposi-Sarkom befällt in erster Linie Haut und Schleimhäute. Zunächst treten rötlich-braune bis violettrote Makulae bevorzugt im Verlauf der Hautspaltlinien auf, meist symmetrisch an den distalen Extremitäten lokalisiert. Diese schreiten dann zu flächenhaften Plaques und/oder harten schmerzhaften Knoten fort. Die Ausbreitung erfolgt nach proximal, zunehmend disseminiert. Häufig sind auch die Schleimhäute betroffen.
Kaposi-Sarkome können die regionalen Lymphbahnen ummauern, was Ödeme im betroffenen Abflussgebiet verursacht. Mechanische Belastungen und Traumen können zum ulzerösen Zerfall führen. Auch innere Organe wie Lymphknoten, Gastrointestinaltrakt, Leber, Lunge, Niere und Milz können betroffen sein. Lymphatischer oder viszeraler Befall kommt mitunter auch isoliert vor, ohne dass die Haut beteiligt ist.
Der
Verlauf des KS ist sehr variabel und reicht von einzelnen, über
Jahre stationären Läsionen bis zu ausgesprochen
aggressiven,
vor allem bei HIV-Infizierten innerhalb weniger Wochen zum Tode
führenden Verläufen. Spontanregressionen sind möglich und
hinterlassen hämorrhagische Hyperpigmentierungen. Einblutungen
werden zu periläsionalen Verfärbungen (ockergelbe Purpura).
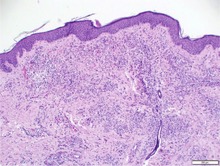
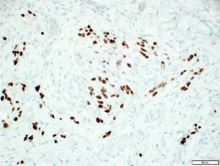
Abb. 2 Histologischer Schnitt Kaposi-Sarkom a) 100X HE b) 400X HHV8
© Stefan Esser
Gewöhnlich findet sich bei Erstdiagnose – in der Regel bei bislang nicht antiretroviral behandelten HIV-Infizierten – ein multilokuläres Geschehen. Die typischen Läsionen können sich innerhalb weniger Tage entwickeln. Sie beginnen als Makulae in den Hautspaltenlinien und entwickeln sich weiter zu Papeln oder papulösen Tumoren. Vor der Zeit der cART fanden sich bei vielen Patienten orale Läsionen als Primärmanifestation, aber auch typischerweise Läsionen am Penis. Die Hautveränderungen sind für den betroffenen Patienten stigmatisierend. Die z.T. ausgedehnten Lymphödeme und Exulzerationen besonders an den Füßen führen zu schmerzhaften Bewegungseinschränkungen. Die Organbeteiligung ist bei aggressivem Verlauf unbehandelt lebensbedrohlich. So gut wie alle Organe, einschließlich des gesamten Gastrointes-tinaltraktes, aber auch Herz, Leber und Lungen können betroffen sein. Selten sind Beteiligungen des ZNS und der Augen.
Diagnose
Empfohlen wird eine Stufendiagnostik. Bei HIV-Infizierten ist das kutane Kaposi-Sarkom für den erfahrenen Untersucher eine Blickdiagnose. Im Zweifel, vor Therapiebeginn und bei Nicht-HIV-Infizierten ist eine Biopsie und histologische Untersuchung empfehlenswert; ein HIV-Test obligat. Eine zytologische Untersuchung ist in der Regel nicht ausreichend.
Ist die Diagnose gesichert, sollte man zur Feststellung der Ausbreitung eine Sonographie des Abdomens sowie eine Röntgenuntersuchung des Thorax gegebenenfalls eine Computertomographie von Adomen bzw. Thorax veranlassen. Bei sichtbarem Schleimhautbefall kann man eine Endoskopie des Gastrointestinaltraktes bzw. Bronchoskopie erwägen, wenn Prädiktoren für eine mögliche Beteiligung vorhanden sind und sich aus dem Untersuchungsergebnis Konsequenzen ergeben.
Als Differentialdiagnosen kommen neben einer Akroangiodermatitis bei chronischer Veneninsuffizienz, Hämangiome, andere Angiosarkome, eine bazilläre Angiomatose, ein Morbus Gougerot-Blum, Melanommetastasen, aber auch ein Erythema elevatum et diutinum in Frage.
Prognose
Es gibt keine allgemein gültige Stadien-Einteilung für das Kaposi-Sarkom. Die ACTG hat HIV-assoziierte Kaposi-Sarkome gemäß den drei Faktoren Tumor, Immunsystem und Systembeteiligung (TIS) eingeteilt (Tab. 1). Diese Einteilung stammt aus der Prä-cART-Ära und lässt daher keinen Rückschluss auf die Prognose zu. Kürzlich wurde eine T-Einteilung vorgeschlagen: T0 begrenzte Erkrankung, T1 Tumor-assoziiertes Ödem oder Ulceration oder ausgedehnter oraler oder gastrointestinaler Befall oder nicht-knotige viszerale Kaposi-Sarkome.
| Kriterien | |||
|---|---|---|---|
| Prognose | Tumor | Immunsystem | Systembeteiligung |
| Günstig | Nur Haut/Lymph - knotenbefall (minimale Gaumenbeteiligung) | CD4 ≥ 200/μl | Keine opportunis- tische Infektion, keine B-Symptomatik und Karnofsky ≥ 70% |
| Schlecht | Tumor mit Ödembildung oder Ulzeration, ausgedehnter oraler Befall, innerer Befall ausgenommen Lymphknoten | CD4 <200μl | Opportunistische Infektionen, andere AIDS-definierte Erkrankungen, B-Symptomatik oder Karnofsky <70% |
Tab. 1 Prognose bei HIV-assoziiertem Kaposi-Sarkom. TIS-Einteilung der ACTG
Therapie
Die Therapie orientiert sich an den vier epidemiologisch-klinischen Varianten. Beim klassischen Kaposi-Sarkom werden aufgrund des oft hohen Lebensalters der Erkrankten individualisierte Therapiekonzepte und häufig auch nur lokale Behandlungen bzw. Bestrahlungen bevorzugt. Exzisionen sollten nur bei funktionell störenden Veränderungen und raschem Handlungsbedarf erwogen werden. Bei ausgedehnten Befunden, systemischem Befall und progredienten Verläufen ist eine systemische Chemotherapie, in der Regel mit pegyliertem liposomalem Doxorubicin, indiziert. Das endemische afrikanische Kaposi-Sarkom spricht mit Ausnahme der lymphadenopathischen Verlaufsform in der Regel gut auf systemische Therapiemaßnahmen an. Beim iatrogen-immunsuppressiv bedingten Kaposi-Sarkom bilden sich die Tumorherde meistens nach Beendigung der Immunsuppression zurück.
AIDS-assoziiertes Kaposi-Sarkom
Pathogenese
Die Pathogenese des Kaposi-Sarkoms wird zunehmend besser verstanden. Mit molekularbiologischen Methoden und PCR-unterstützter In-situ-Hybridisierung gelang in Endothelzellen und Spindelzellen sowohl in AIDS-assoziierten Kaposi-Sarkomen, als auch in Kaposi-Sarkomen von HIV-negativen Patienten in >95% der Fälle der Nachweis von DNA-Sequenzen eines als KS-assoziiertes (KSHV) bzw. HHV-8 bezeichneten humanen Herpesvirus. Deshalb wird dem sexuell aber auch über Speichel und Blut übertragbaren HHV-8 eine entscheidende Rolle bei der Entstehung von Kaposi-Sarkomen zugesprochen.
Für die Entstehung von Kaposi-Sarkomen ist HHV-8 eine notwendige, aber allein nicht hinreichende Voraussetzung. Kofaktoren sind z.B. das HIV-TAT-Gen und Zytokine wie Interferon-γ und Vascular Endothelial cell Growth Factor (VEGF). Im Genom von HHV-8 konnten Gene mit onkogenen Eigenschaften (c-myc, bcl-2) (transformierend, chemoattraktiv, wachstumsfördernd, anti-apoptotisch) und andere, die die Bindung, das Zellwachstum, die Inflammation und die Angiogenese beeinflussen, identifiziert werden. Die Expression dieser Genprodukte in KS-Spindelzellen in vivo trägt entscheidend zur KS-Entwicklung bei.
HHV-8 findet sich nicht nur regelmäßig im Kaposi-Sarkom, sondern auch in bestimmten B-Zell-Lymphomen (‚body cavity-based large B cell lymphoma‘) und im multizentrischen Morbus Castleman, jedoch nicht in anderen vaskulären Tumoren. Zudem wurden im peripheren Blut von HIV-positiven KS-Patienten sowohl mit HHV-8 infizierte Leukozyten als auch KS-Zellen gefunden. In manchen Regionen, in Italien oder Zentralafrika, ist HHV-8 auch bei bis zu 50% der Normalbevölkerung nachweisbar.
Die cART hat einen protektiven Effekt im Hinblick auf das Kaposi-Sarkom, selbst bei Patienten mit gutem Immunsystem. Beim manifesten AIDS-assoziierten Kaposi-Sarkom kann die kombinierte, kontinuierliche antiretrovirale Therapie (cART) bei vorher nicht antiretroviral behandelten Patienten zum Progressionsstillstand bzw. sogar zur vollständigen Remission führen. Deshalb sollte bei HIV-Patienten spätestens mit Auftreten eines Kaposi-Sarkoms eine antiretrovirale Therapie eingeleitet werden. Die Medikamentenkombination spielt für das Ansprechen des Kaposi-Sarkoms keine Rolle. Ausschlaggebend sind allein die virologische Effektivität und die cART-bedingte Immunrekonstitution. In einigen Fällen kann im Rahmen des Immunrekonstitutionssyndroms eine vorüber-gehende, allerdings oft nicht unerhebliche Befundverschlechterung auftreten. Diese Patienten sollten zusätzlich mit einer sys-temischen Chemotherapie behandelt werden. Bei gleichzeitiger Neudiagnose eines fortgeschrittenen Kaposi-Sarkoms mit Organbeteiligung und einer HIV-Infektion wird die gleichzeitige Einleitung der antiretroviralen und der sys-temischen Kaposi-Sarkom-Therapie wie unten beschrieben empfohlen. Wird bei bereits antiretroviral therapierten Patienten ein Kaposi-Sarkom diagnostiziert, sollte die Effektivität der antiretroviralen Therapie überprüft und diese gegebenenfalls optimiert werden.
Systemische Therapie
Indikation zur spezifischen Therapie sind fortgeschrittene Kaposi-Sarkome, z.B. viszeraler Befall oder Lymphödeme, ein rasches Fortschreiten der Läsionen oder ein symptomatischer Befall. Die Standardtherapie des Aids-assoziierten bzw. fortgeschrittenen Kaposi-Sarkoms besteht in der Gabe von pegyliertem, liposomalem Doxorubicin (Caelyx® oder Doxil®) in einer Dosis von 20 mg pro m2 Körperoberfläche im Abstand von zwei bis drei Wochen bis zur vollständigen klinischen Remission. Im Regelfall erreicht man mit 6-8 Zyklen ein gutes klinisches Ansprechen. Eine komplette Remission erreichen bis zu 80% der Patienten. Klinische Verlaufskontrollen werden nach 2-3 Monaten durchgeführt. Bei guter Rückbildung der Tumorläsionen ohne Vollremission wird nach 4-6 Monaten der weitere Verlauf zunächst abgewartet.
Wie vor jeder Anthrazyklin-Therapie sollte – auch wenn das Risiko bei einer kumulativen Dosis von 450 mg/m2 gering ist – eine Echokardiographie zur Bestimmung der linksventrikulären Ejektionsfraktion erfolgen, da neben der Myelotoxizität auch ein kardiotoxisches Risiko besteht. Unter der Gabe von liposomalem Doxorubicin können ferner schmerzhafte makulöse Erytheme an Händen und Füßen (palmoplantare Erythrodysästhesie) auftreten. Allerdings wird diese Nebenwirkung bei den für das Kaposi-Sarkom empfohlenen Dosierungen selten, bei höheren Einzeldosen öfter beobachtet.
Eine Alternative ist liposomales, Daunorubicin (DaunoXome®), was allerdings in einer kleinen nicht ausreichend gepowerten Studie weniger wirksam war als das pegylierte liposomale Doxorubicin.
Als Zweitlinientherapie steht das Taxan Paclitaxel zur Verfügung. In der Originalarbeit von Gill et al. wurde eine Dosis von 100 mg/m2 alle zwei Wochen eingesetzt. Da sich aber bei anderen Erkrankungen (z.B. Mamma-Karzinom) mittlerweile die wöchentliche Gabe in reduzierter Dosis als besser verträglich und als mindestens genauso effektiv erwiesen hat, kann auch beim Kaposi-Sarkom eine wöchentliche Gabe eingesetzt werden. Zu beachten sind hier auch Myelotoxizität, Alopezie und Onychodystrophie. Bei HIV-Infizierten sind Interaktionen mit der cART zu beachten. Insbesondere geboosterte Proteasehemmer können die Paclitaxel-Spiegel signifikant erhöhen.
Ein zweiwöchiger Zyklus von Vincristin (1-2 mg) und Bleomycin 10 IU/m2 kann auch eine Remission induzieren. Dies ist kostengünstiger, aber mit einer höheren Toxizität verbunden.
Beim
HIV-assoziierten Kaposi-Sarkom können bei guten CD4-Zellzahlen (>350
Zellen/μl) bzw. gutem Immunstatus alternativ auch systemisch
Interferone eingesetzt werden. Pegylierte Interferone (wöchentliche
Gabe möglich und besser verträglicher als klassische Interferone)
sind für das Kaposi-Sarkom nicht zugelassen, aber möglicherweise
besser wirksam und einfacher zu verabreichen. Ein standardisiertes
Regime existiert nicht (Tab. 2).
| Therapie | Dosierung | Kommentar |
|---|---|---|
| Pegyliertes liposomales Doxorubicin
(Caelyx
®
oder Doxil
®) | 20 mg/m
2
i.v.
alle 2 Wochen | Therapie der Wahl, cave
Myelo- und Kardiotoxizität,
Hand-Fuß-Syndrom |
| Liposomales Daunorubicin (DaunoXone ®) | 40 mg/m2 i.v. alle 2-3 Wochen | Alternative, möglicherweise etwas weniger wirksam als pegyliertes liposomales Doxirubicin |
| Interferon- α 2a (Roferon ® ) | 3-6x 10 6 I.E. s.c. oder i.m. 3x / Woche, (Dosis je nach Ver - träglichkeit steigern) | Zum Teil erhebliche Neben- wirkungen, wohl etwas schwächer als Doxorubicin. Nur bei CD4-Zellen >200 /μl und begrenztem Befall |
| Pegyliertes Interferon- α 2b* (PegIntron ®) | 50 μg s.c. 1x / Woche | Wie IFN- α (2a,b), aber besser verträglich, wenig Daten beim Aids-assoziierten KS Keine Zulassung - Off Label Use |
| Paclitaxel (Taxol ®) | 100 mg/m² i.v. alle 2 Wochen oder 135 mg/ m 2 i.v. alle 3 Wochen | Reservemittel. Cave Neutropenie, periphere Neuropathie, Allergien, Alopezie Keine Zulassung - Off Label-Use Interaktionen mit cART, vor allem geboosterten Proteasehemmern |
Tab. 2 Systemische und Immuntherapie des Kaposi-Sarkoms
Lokale Therapie
Bei einzelnen störenden (Füße, Gesicht) Kaposi-Sarkom-Läsionen sind lokale chirurgische oder medikamentöse Therapiemaßnahmen ausreichend. Nach chirurgischer Exzision sind Narbenrezidive allerdings häufig.
Das Kaposi-Sarkom ist strahlensensibel. Daher ist auch eine Strahlentherapie eine Therapieoption, wobei insbesondere fraktionierte Einzeldosen mit Röntgenweichstrahlen empfohlen werden. Bei der Bestrahlung sollte das Gebiet 0,5-1 cm größer als die Läsion gewählt werden, um Tumorzellen zu erfassen, die sich entlang der Gefäße ausbreiten. Oberflächliche makulöse Läsionen oder Plaques sprechen gut auf eine tägliche Dosis von 4-5 Gy (Gesamtdosis 20-30 Gy fraktioniert 3 Mal/Woche) an. Bei großen Läsionen mit Lymphödem kann man eine Bestrahlung mit schnellen Elektronen erwägen.
Andere Lokaltherapien reichen von der Camouflage über die intraläsionale Injektion von Vincristin bis zum experimentellen topischen Einsatz von Retinoiden, Interferon sowie Imiquimod-Creme.
Neue Therapieansätze
Viele neue Behandlungsansätze werden geprüft: Virostatika, Zytokine und Angiogenese-Inhibitoren. Das Valganciclovir hemmt in vitro die HHV8-Replikation. Beim klassischen Kaposi-Sarkom zeigte sich allerdings kein klinischer Effekt und bei Aids-assoziiertem Kaposi-Sarkom fehlen klinische Studien. Lenalidomid, ein Immunmodulator mit Anti-Angiogenese-Effekt, wird nach ersten positiven Fallberichten in einer frühen klinischen Studie bei Patienten mit Aids-assoziiertem Kaposi-Sarkom mit/ohne viszeralem Befall geprüft. Sirolimus und Everolimus hatten bei HIV-negativen Nierentransplantierten einen guten Effekt in unkontrollierten Studien. Der VEGF-Antikörpers Bevacizumab zeigte in einer kleinen Untersuchung eine moderate Wirkung beim Aids-assoziierten Kaposi-Sarkom. Die Substanz wird derzeit in Kombination mit liposomalem Doxorubicin geprüft. Erste positive Ergebnisse früher Studien bei Aids-Patienten fanden sich auch unter Imatinib, einem Tyrosinkinase-Hemmer, der vor allem bei Leukämien eingesetzt wird.
Residuen
Nach erfolgreicher Behandlung von Kaposi Sarkomen bleiben häufig noch lange z.T. ästhetisch störende postinflammatorische Hyperpigmentierungen sichtbar, die nicht mit aktiven KS-Läsionen verwechselt werden dürfen. Auch chronische, behandlungsbedürftige Lymphödem können zurückbleiben. Deshalb sollte bei Lymphödemen frühzeitig eine begleitende Physiotherapie eingeleitet werden.
Literatur bei den Verfassern
*Dieser
Text ist eine Kurzfassung der Leitlinien der Deutschen Gesellschaft
für Hämatologie
und Medizinische Onkologie e.V. zum
Kaposi-Sarkom von Stefan Esser und Franz Mosthaf
(Onkopedia Juli
2017) und des Reviews HIV-Associated Kaposi’s Sarcoma von Christian
Hoffmann, Michael Sabranski und Stefan Esser (Oncol Res Treat
2017;40:94-98)











 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
