Johannes R. Bogner, München
Integraseinhibitoren im Vergleich
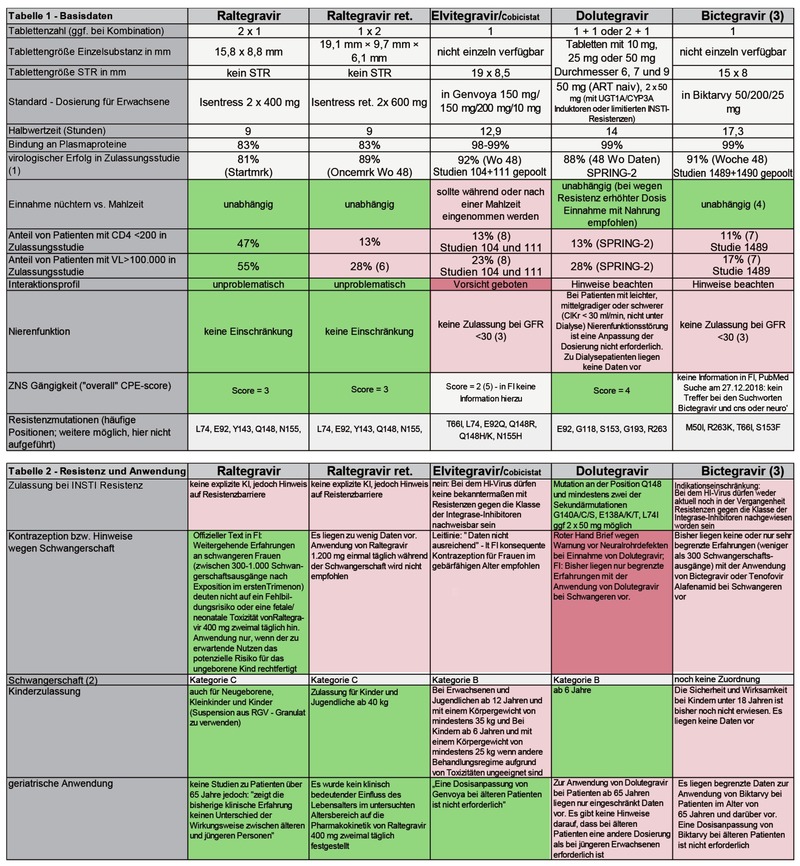
Seit der Zulassung von Raltegravir (RAL) als erstem Integrase-Strang-Inhibitor (INSTI) im Jahr 2007 hat sich zunehmend die Kombination INSTI+2RTI als Therapiestandard etabliert. Bei therapienaiven Patienten machen INSTI-haltige Dreifachkombinationen inzwischen mehr als die Hälfte der Verordnungen aus. Aber auch bei therapieerfahrenen Patienten kommen INSTI im Rahmen von Therapiewechseln zum Einsatz. Für Raltegravir gibt es hier auch entsprechende Daten, denn bei der Raltegravir-Zulassung wurde sowohl die Anwendung im Salvage-Bereich als auch der Einsatz in der ersten Therapie überprüft. Bei den neueren Integraseinhibitoren konzentriert sich das Interesse dagegen in erster Linie auf die Studiendaten zur Ersttherapie. Grundsätzlich ist für Integraseinhibitoren der Einsatz in allen Therapielinien sinnvoll, sofern nicht eine Resistenz vermutet werden muss oder nachgewiesen ist. Leider ist es aber immer noch nicht gelungen, die genotypische Resistenztestung für INSTI als reguläre GKV-Laborleistung zu etablieren.
Vier INSTI verfügbar
In der Erst-Therapie stehen heute vier verschiedene INSTI zur Verfügung. Sie bilden zwar eine Therapieklasse, haben jedoch deutlich unterschiedliche Eigenschaften was die Pharmakologie, Pharmakokinetik, Wirkung und vor allem das Nebenwirkungsprofil betrifft. Hier soll es angesichts der in den letzten Jahren neu zugelassenen Substanzen Elvitegravir (EVG), Dolutegravir (DTG) und Bictegravir (BIC) in erster Linie um den Vergleich der Substanzeigenschaften gehen. Alle Substanzen bieten Vor- und Nachteile, die ein differenziertes Vorgehen erlauben und damit die Möglichkeit bieten, die antiretrovirale Therapie individuell auf den Patienten und seine Lebensumstände abzustimmen.
Gruppeneigenschaften
Auch wenn der Wirkmechanismus über die Hemmung der viralen Integration derselbe ist, so sind doch Unterschiede im Metabolismus und in der Möglichkeit von Interaktionen zu beachten. Bezüglich einiger Parameter sind dennoch für alle vier Substanzen in der jeweiligen Fachinformation nahezu gleich lautende Hinweise gegeben: Die gleichzeitige Einnahme von INSTI mit Magnesium- oder Aluminium-enthaltenden Antazida ist wegen Resorptionsproblemen zu vermeiden. Darüber hinaus ist bei allen Substanzen ein Hinweis auf die Möglichkeit von Knochenveränderungen bis hin zur Osteonekrose enthalten. Im Fall von Gelenkschmerzen soll ein Arzt aufgesucht werden. Es ist aber hochwahrscheinlich, dass es sich hierbei eher um die Nebenwirkung des Tenofovir-haltigen Backbones als der INSTI selbst handelt.
Ferner
ist bei allen INSTI ein Hinweis auf ein mögliches
Immun-Rekonstitutions-Syndroms enthalten. Dies hat mit der
virologischen Gruppeneigenschaft zu tun, dass bei
INSTI-Behandlung die Viruslast rascher sinkt als bei anderen
Therapien.
Bezüglich der antiretroviralen Wirksamkeit ist nach Studienlage für alle Substanzen eine Unterdrückung der Viruslast unter die Nachweisgrenze in der Größenordnung von 90 Prozent nach 48 Therapiewochen berichtet worden. Allerdings sei darauf hingewiesen, dass RAL (2x 400 mg unretardiert) die einzige Substanz ist, bei der in der Zulassungsstudie die Wirksamkeit auch an einem größeren Anteil von Patienten mit sehr hoher Viruslast (55% Baseline-Viruslast >100.000 K/ml) und sehr fortgeschrittenem Immundefekt (47% CD4 <200/µl) geprüft wurde. Im Vergleich dazu ist der Anteil von Patienten mit hoher Viruslast in den Zulassungsstudien der anderen Substanzen mit 17% bis 28% sowie der Anteil von Patienten mit schlechtem Immunsystem im Bereich von 13% eher niedrig.
Raltegravir
Raltegravir
(RAL) ist seit 2007 zugelassen und wird in der Praxis auch in allen
Therapielinien eingesetzt. In der Erstlinientherapie ist die
Kombination von guter subjektiver Verträglichkeit und rascher
virologischer Wirkung.1-5
In meinem Beitrag zum INSTI-Vergleich in HIV&more 1/2014 sprach
ich bei der Substanzkombination RAL+Truvada (TVD) vom „Mercedes
unter den Erstlinientherapien“ in Anlehnung an einige
Assoziationen, die dieser Vergleich birgt: Sicherheit und
Geschwindigkeit in der Wirkung, gute und komfortable Verträglichkeit
und langdauernde Adhärenz und Bequemlichkeit (am ehesten für den
Arzt, da praktisch keine Interaktionen zu beachten sind). Da in der
Studie
QD-Mrk6
zur einmal täglichen Anwendung im Vergleich zur zweimal täglichen
Anwendung ein signifikant niedrigerer Prozentsatz der Patienten das
Therapieziel erreichte, wurde zunächst von einer QD-Zulassung
abgesehen. Da aber die zweimal tägliche Einnahme für manche
Patienten ein Problem darstellen und zu Adhärenzdefiziten führen
kann, wurde RAL weiterentwickelt und 2017 die retardierte Form von
RAL (1x 1.200 mg/Tag in 2 Tabletten) zugelassen.
Für Raltegravir gibt es neben den Studien zur Anfangstherapie für zahlreiche Therapiesegmente Erfahrungen und Studien.4,7,8
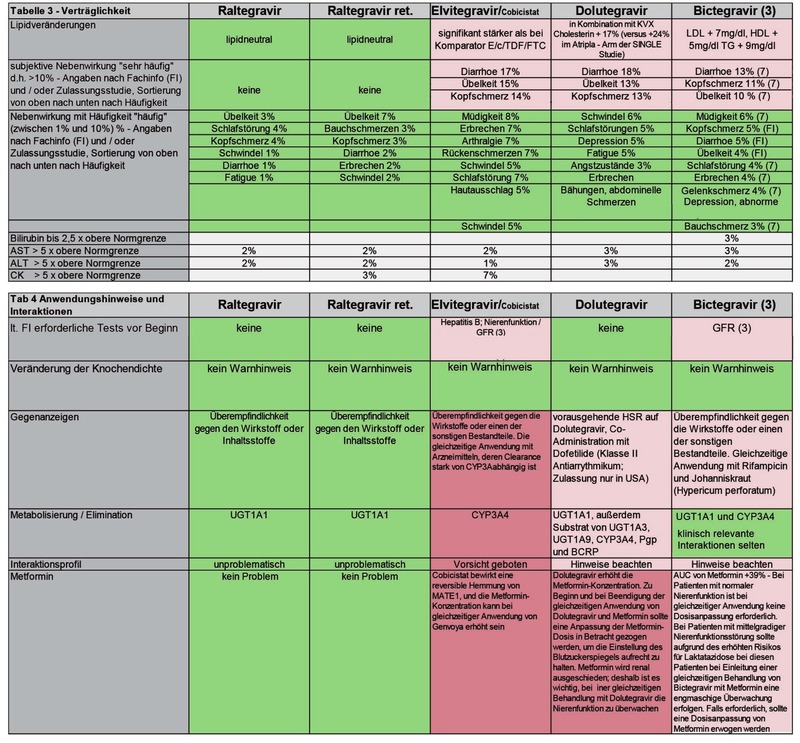
Raltegravir gilt als bewährte und „unkomplizierte“ Substanz mit einer Verträglichkeit, die in den Benchmrk-Studien keinen Unterschied zu Placebo gezeigt hat. Die fehlenden Medikamenten-Interaktionen (Ausnahme: Rifampicin) und der dadurch geringe Beratungsbedarf bei Patienten machen diese Substanz sicher und praktisch in der Anwendung. Raltegravir gilt als „Stoffwechselneutral“ und hat den Vorteil eines guten ZNS-Scores. Die Substanz ist inzwischen auch für Neugeborene zugelassen.
Elvitegravir
Elvitegravir ist aktuell in zwei „single tablet regimen“ (STR) verfügbar, einerseits in der Kombination mit Tenofovirdisoproxil/Emtricitabin (TDF/FTC) unter dem Handelsnamen Stribild® und andererseits in der Kombination mit Tenofoviralafenamid/Emtricitabin (TAF/FTC) unter dem Handelsnamen Genvoya®. Da heute Genvoya® gegenüber Stribild® der Vorzug gegeben wird, erscheint in der Vergleichstabelle nur die Genvoya®-Kombination. Von vielen Patienten wie auch Behandlern wird die Möglichkeit zur einmal täglichen Einnahme bei sicherer virologischer Wirkung als großer Vorteil gesehen.9-15 Pharmakologisch ist das Charakteristikum von Elvitegravir, dass eine Boosterung der Substanz erforderlich ist, um sichere therapeutische Spiegel zu erreichen. Die CYP3A4-Blockade infolge der Boosterung bringt den Nachteil zahlreicher Interaktionen mit Begleitmedikamenten sowie Drogen mit sich, wie man sie sonst bei geboosterten Proteaseinhibitoren (PI) sieht.
Der mit Elvitegravir kombinierte Booster Cobicistat führt zudem zu einer Hemmung tubulärer Transportsysteme in der Niere, was zu einer leichten Erhöhung des Serumkreatinins führt. Das Kriterium einer Eingangs-GFR von >30 ml/min für Genvoya® wird nicht von allen Patienten erfüllt. Für Patienten mit eingeschränkter Nierenfunktion ist hier also Vorsicht geboten bzw. eine Kontraindikation zu beachten.
Elvitegravir wurde zunächst an therapienaiven Patienten geprüft.16 Die Zulassung von Stribild® erfolgte als in den USA daher ausdrücklich für therapienaive Patienten. In der EMA-Zulassung ist ebenfalls die Anwendung für nicht vorbehandelte Patienten ausgewiesen, allerdings mit dem Zusatz „nicht vorbehandelt oder bei denen HIV-1 keine Mutationen aufweist, die bekanntermaßen mit Resistenzen gegen einen der drei antiretroviralen Wirkstoffe von Stribild® assoziiert sind“.17 In der Studie 145 wurde die Fixkombination mit RAL bei therapieerfahrenen Patienten verglichen, wobei sich bis Woche 96 eine Nichtunterlegenheit von EVG gegenüber RAL zeigte.18,19 Die Zulassung von der Fixkombination Genvoya® ist nicht mehr auf therapienaive Patienten eingeschränkt. Genvoya® ist zudem für Kinder zugelassen, wenn eine andere Behandlungsmöglichkeit aufgrund von Toxizitäten nicht möglich ist.
Dolutegravir
Dolutegravir (DTG) wurde 2014 sowohl als Einzelsubstanz (Tivicay®) sowie mit dem Backbone Abacavir/Lamivudin (ABC/3TC) als STR (Triumeq®) zugelassen. Dolutegravir wurde bei therapienaiven Patienten sowohl mit TVD als auch mit ABC/3TC als Backbone untersucht.20-22 Studien an Therapienaiven sind die Studien SINGLE (DTG+ABC/ 3TC versus Efavirenz/TDF/FTC), SPRING-2 (DTG+TDF/FTC oder ABC/ 3TC versus Efavienz/TDF/FTC) und FLAMINGO (DTG+2NRTI versus Darunvavir/r+2NRTI).
Im Gegensatz zu Elvitegravir ist eine pharmakologische Boosterung nicht erforderlich. Dennoch sind auch hier einige Interaktionsmöglichkeiten vorhanden. Ähnlich wie bei Elvitegravir/Cobicistat kommt es unter Dolutegravir zu einer leichten Erhöhung des Serum-Kreatinins durch Hemmung der tubulären Sekretion.
An
therapieerfahrenen Patienten wurde Dolutegravir in der Studie SAILING
geprüft. Hier wurden INSTI-naive Patienten in einen RAL- oder
DTG-Arm randomisiert.23,24
Nach 48 Wochen zeigte sich bei ähnlicher Verträglichkeit ein
leichter Wirkungsvorteil für DTG. In der Studie VIKING-3 wurde DTG
zusammen mit einem optimierten Background-Regime nach Vortherapie mit
RAL oder EVG eingesetzt. DTG zeigte hier bei einer begrenzten Anzahl
bestimmter
INSTI-Resistenzmutationen noch eine Wirksamkeit, auch
wenn die anderen beiden INI bereits durch Resistenzmutationen
wirkungslos waren.
Bictegravir
Mitte
2018 wurde mit Bictegravir ein weiterer INSTI in Form eines STR unter
dem Handelsnamen Biktarvy®
verfügbar.25,26
Bictegravir ist ebenso wie Elvitegravir nur in Fixkombination und
zwar mit TAF/FTC erhältlich und nicht als Einzelsubstanz zur freien
Kombination. Im Gegensatz zu Elvitegravir ist bei Bictegravir kein
Booster erforderlich. Das Fehlen eines Boosters ist allerdings nicht
gleichbedeutend mit einer unproblematischen Handhabung hinsichtlich
der Interaktionsmöglichkeit. Bictegravir ist aufgrund der beiden
Abbauwege UGT1A1 und CYP3A4 hierfür etwas
anfälliger. Auch
hinsichtlich der Nebenwirkungsrate bietet Bictegravir keinen Vorteil
gegenüber anderen INSTI bzw. ist sogar ungünstiger zu bewerten.
Diese neueste Kombination hat somit nicht nur Vorteile, dennoch wurde sie von vielen Behandlern als „die Lösung“ jeglicher Problematik einer differenzierten Indikation angesehen. Dies führte dazu, dass in vielen Zentren Patienten von gut funktionierenden Regimen systematisch auf das Bictegravir-STR umgestellt wurden. Angesichts der Tatsache, dass es sich bei Bictegravir um den INSTI mit der bislang geringsten Langzeit-Erfahrung handelt, ist diese Entwicklung der Therapielandschaft durchaus überraschend.
![]()
1) Vergleichbarkeit eingeschränkt durch unterschiedliche Studienpopulationen und Baseline - Werte
2)für alle Substanzen gilt: nicht in der Stillzeit empfohlen / Stillen bei HIV-infizierten Müttern in Europa nicht empfohlen
3) bezieht sich auf die Fixkombination mit Tenofovir-Alafenamid und ist insofern nicht direkt mit den anderen beiden Substanzen vergleichbar
4) jedoch mit fettreicher Mahlzeit +24% Aufnahme 5) Shibani S. Mukerji MD, PhD presentation 2017 ID week
6) Cahn, IAS 2017 presentation 7)Studie 1489 Biktarvy vs. Triumeq Gallant et al http://dx.doi.org/10.1016/S0140-6736(17)32299-7
Die
Tabelle zur Differentialindikation beruht für alle drei Substanzen
auf Originalinformationen aus der „Fachinformation“ (FI) der
Hersteller in ihrer aktuellen Version.
Darüber hinaus wurde
insbesondere zur Verträglichkeit und Wirksamkeit auf Originaldaten
in den publizierten Zulassung Studien zurückgegriffen.
Fazit
Integraseinhibitoren
sind in der Ersttherapie aus der ART nicht mehr wegzudenken. Im Sinn
einer individualisierten
Behandlung ist bei der Auswahl von
nunmehr vier verschiedenen Substanzen „für jeden Patienten das
Richtige dabei“. Mögen die hier erarbeiteten Tabellen bei der
Auswahl behilflich sein.
1 Rockstroh JK, DeJesus E, Lennox JL, Yazdanpanah Y, Saag MS, Wan H, et al. Durable efficacy and safety of raltegravir versus efavirenz when combined with tenofovir/emtricitabine in treatment-naive HIV-1-infected patients: final 5-year results from STARTMRK. J Acquir Immune Defic Syndr. 2013;63(1):77-85.
2 DeJesus E, Rockstroh JK, Lennox JL, Saag MS, Lazzarin A, Zhao J, et al. Efficacy of raltegravir versus efavirenz when combined with tenofovir/emtricitabine in treatment-naive HIV-1-infected patients: week-192 overall and subgroup analyses from STARTMRK. HIV Clin Trials. 2012;13(4):228-32.
3 Lennox JL, Dejesus E, Berger DS, Lazzarin A, Pollard RB, Ramalho Madruga JV, et al. Raltegravir versus Efavirenz regimens in treatment-naive HIV-1-infected patients: 96-week efficacy, durability, subgroup, safety, and metabolic analyses. J Acquir Immune Defic Syndr. 2010;55(1):39-48.
4 Steigbigel RT, Cooper DA, Kumar PN, Eron JE, Schechter M, Markowitz M, et al. Raltegravir with optimized background therapy for resistant HIV-1 infection. N Engl J Med. 2008;359(4):339-54.
5 Lennox JL, DeJesus E, Lazzarin A, Pollard RB, Madruga JV, Berger DS, et al. Safety and efficacy of raltegravir-based versus efavirenz-based combination therapy in treatment-naive patients with HIV-1 infection: a multicentre, double-blind randomised controlled trial. Lancet. 2009;374(9692):796-806.
6 Eron JJ, Jr., Rockstroh JK, Reynes J, Andrade-Villanueva J, Ramalho-Madruga JV, Bekker LG, et al. Raltegravir once daily or twice daily in previously untreated patients with HIV-1: a randomised, active-controlled, phase 3 non-inferiority trial. Lancet Infect Dis. 2011;11(12):907-15.
7 Eron JJ, Cooper DA, Steigbigel RT, Clotet B, Gatell JM, Kumar PN, et al. Efficacy and safety of raltegravir for treatment of HIV for 5 years in the BENCHMRK studies: final results of two randomised, placebo-controlled trials. Lancet Infect Dis. 2013;13(7):587-96.
8 Eron JJ, Young B, Cooper DA, Youle M, Dejesus E, Andrade-Villanueva J, et al. Switch to a raltegravir-based regimen versus continuation of a lopinavir-ritonavir-based regimen in stable HIV-infected patients with suppressed viraemia (SWITCHMRK 1 and 2): two multicentre, double-blind, randomised controlled trials. Lancet. 2010;375(9712):396-407.
9 DeJesus E, Rockstroh JK, Henry K, Molina JM, Gathe J, Ramanathan S, et al. Co-formulated elvitegravir, cobicistat, emtricitabine, and tenofovir disoproxil fumarate versus ritonavir-boosted atazanavir plus co-formulated emtricitabine and tenofovir disoproxil fumarate for initial treatment of HIV-1 infection: a randomised, double-blind, phase 3, non-inferiority trial. Lancet. 2012;379(9835):2429-38.
10 Sax PE, DeJesus E, Mills A, Zolopa A, Cohen C, Wohl D, et al. Co-formulated elvitegravir, cobicistat, emtricitabine, and tenofovir versus co-formulated efavirenz, emtricitabine, and tenofovir for initial treatment of HIV-1 infection: a randomised, double-blind, phase 3 trial, analysis of results after 48 weeks. Lancet. 2012;379(9835):2439-48.
11 Zolopa A, Sax PE, DeJesus E, Mills A, Cohen C, Wohl D, et al. A randomized double-blind comparison of coformulated elvitegravir/cobicistat/emtricitabine/tenofovir disoproxil fumarate versus efavirenz/emtricitabine/tenofovir disoproxil fumarate for initial treatment of HIV-1 infection: analysis of week 96 results. J Acquir Immune Defic Syndr. 2013;63(1):96-100.
12 Rockstroh JK, DeJesus E, Henry K, Molina JM, Gathe J, Ramanathan S, et al. A randomized, double-blind comparison of coformulated elvitegravir/cobicistat/emtricitabine/tenofovir DF vs ritonavir-boosted atazanavir plus coformulated emtricitabine and tenofovir DF for initial treatment of HIV-1 infection: analysis of week 96 results. J Acquir Immune Defic Syndr. 2013;62(5):483-6.
13 Clumeck N, Molina JM, Henry K, Gathe J, Rockstroh JK, Dejesus E, et al. A randomized, double-blind comparison of single tablet regimen elvitegravir/cobicistat/emtricitabine/tenofovir DF versus ritonavir-boosted atazanavir plus emtricitabine/tenofovir DF for initial treatment of HIV-1 infection: analysis of week 144 results. J Acquir Immune Defic Syndr. 2013.
14 Wohl DA, Cohen C, Gallant JE, Mills A, Sax PE, Dejesus E, et al. A randomized, double-blind comparison of single tablet regimen elvitegravir/cobicistat/emtricitabine/tenofovir DF versus single tablet regimen efavirenz/emtricitabine/tenofovir DF for initial treatment of HIV-1 infection: analysis of week 144 results. J Acquir Immune Defic Syndr. 2013.
15 Sax PE, Wohl D, Yin MT, Post F, DeJesus E, Saag M, et al. Tenofovir alafenamide versus tenofovir disoproxil fumarate, coformulated with elvitegravir, cobicistat, and emtricitabine, for initial treatment of HIV-1 infection: two randomised, double-blind, phase 3, non-inferiority trials. Lancet. 2015;385(9987):2606-15.
16 Gilead 2013;Pageshttp://www.gilead.com/~/media/ Files/pdfs/medicines/hiv/stribild/stribild_pi.pdf on 11.01.2014.
17 EMA 2013;Pageshttp://www.ema.europa.eu/docs/de_DE/document_library/EPAR_-_Product_Information/human/002574/WC500144272.pdf on 11.01.2014.
18 Elion R, Molina JM, Arribas Lopez JR, Cooper D, Maggiolo F, Wilkins E, et al. A Randomized Phase 3 Study Comparing Once-Daily Elvitegravir to Twice-Daily Raltegravir in Treatment-Experienced Subjects with HIV-1 infection: 96-Week Results. J Acquir Immune Defic Syndr. 2013.
19 Elion R, Molina JM, Ramon Arribas Lopez J, Cooper D, Maggiolo F, Wilkins E, et al. A randomized phase 3 study comparing once-daily elvitegravir with twice-daily raltegravir in treatment-experienced subjects with HIV-1 infection: 96-week results. J Acquir Immune Defic Syndr. 2013;63(4):494-7.
20 Walmsley SL, Antela A, Clumeck N, Duiculescu D, Eberhard A, Gutierrez F, et al. Dolutegravir plus abacavir-lamivudine for the treatment of HIV-1 infection. N Engl J Med. 2013;369(19):1807-18.
21 Raffi F, Rachlis A, Stellbrink HJ, Hardy WD, Torti C, Orkin C, et al. Once-daily dolutegravir versus raltegravir in antiretroviral-naive adults with HIV-1 infection: 48 week results from the randomised, double-blind, non-inferiority SPRING-2 study. Lancet. 2013;381(9868):735-43.
22 Raffi F, Jaeger H, Quiros-Roldan E, Albrecht H, Belonosova E, Gatell JM, et al. Once-daily dolutegravir versus twice-daily raltegravir in antiretroviral-naive adults with HIV-1 infection (SPRING-2 study): 96 week results from a randomised, double-blind, non-inferiority trial. Lancet Infect Dis. 2013;13(11):927-35.
23 Cahn P, Pozniak AL, Mingrone H, Shuldyakov A, Brites C, Andrade-Villanueva JF, et al. Dolutegravir versus raltegravir in antiretroviral-experienced, integrase-inhibitor-naive adults with HIV: week 48 results from the randomised, double-blind, non-inferiority SAILING study. Lancet. 2013;382(9893):700-8.
24 Eron JJ, Clotet B, Durant J, Katlama C, Kumar P, Lazzarin A, et al. Safety and efficacy of dolutegravir in treatment-experienced subjects with raltegravir-resistant HIV type 1 infection: 24-week results of the VIKING Study. J Infect Dis. 2013;207(5):740-8.
25 Gallant J, Lazzarin A, Mills A, Orkin C, Podzamczer D, Tebas P, et al. Bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir, abacavir, and lamivudine for initial treatment of HIV-1 infection (GS-US-380-1489): a double-blind, multicentre, phase 3, randomised controlled non-inferiority trial. Lancet. 2017;390(10107):2063-72.
26 Gallant JE, Thompson M, DeJesus E, Voskuhl GW, Wei X, Zhang H, et al. Antiviral Activity, Safety, and Pharmacokinetics of Bictegravir as 10-Day Monotherapy in HIV-1-Infected Adults. J Acquir Immune Defic Syndr. 2017;75(1):61-6.
27 Wohl D, Clarke A, Maggiolo F, Garner W, Laouri M, Martin H, et al. Patient-Reported Symptoms Over 48 Weeks Among Participants in Randomized, Double-Blind, Phase III Non-inferiority Trials of Adults with HIV on Co-formulated Bictegravir, Emtricitabine, and Tenofovir Alafenamide versus Co-formulated Abacavir, Dolutegravir, and Lamivudine. Patient. 2018;11(5):561-73.











 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
