Martin Hartmann, Heidelberg
HPV-Impfung und HIV-Infektion
Bei HIV-Infektion ist die Prävalenz und Inzidenz einer HPV-Infektion erhöht. In den Läsionen lassen sich mehr Genotypen mit einer erhöhten HPV-Viral Load nachweisen. Therapeutisch sind die Heilungsraten bei HIV-Patienten niedriger bei einer erhöhten Rezidiv-Rate. Dies gilt auch für die XINs (CIN, VIN und AIN). Auch die immunologisch induzierte Regression ist bei HIV-Infektion vermindert, das Rezidiv-Risiko bei CIN ist bei HIV-Patienten doppelt so hoch wie bei HIV-negativen. Bei behandelter HIV-Infektion mit ART fallen die Unterschiede geringer aus. Unter PrEP steigen die HPV-Infektionen an.1
Empfehlungen zur HPV-Impfung bei Menschen mit HIV
BHIVA (British HIV Association)
- Wir empfehlen die Impfung anzubieten
- allen nicht geimpften HIV-positiven Männern und Frauen bis 26 Jahre unabhängig von CD4-Zahl, ART und Viruslast
- allen HIV-positiven MSM bis 40 unabhängig von CD4-Zahl, ART und Viruslast
- allen HIV-postiven Frauen bis 40 unabhängig von CD4-Zahl, ART und Viruslast
- Wir schlagen vor, die Impfung bei ART-Naive mit CD4-Zellen <200/µl zu verschieben bis dass sich der Patient unter ART stabilisiert hat.
- Wir empfehlen drei Dosen des viervalenten Impfstoffes (0, 1-2, and 6 Monate).
- Wir empfehlen dieses 3-Dosis-Schema für Menschen mit HIV. Wird das Impfschema unterbrochen, sollte die Serie eher beendet als erneut gestartet werden.
- Wir empfehlen für alle Menschen mit HIV, die im Alter unter 18 Jahren weniger als 3 Dosen erhalten haben, einen 3-Dosis-Zyklus zu beenden.
- Wir empfehlen bei Frauen und Männern 9vHPV (Garadsil®9) anzuwenden sobald verfügbar anstatt 4vHPV (Garadsil®4).
- Wir schlagen vor, die HIV-Impfung zu erwägen für Menschen mit HIV und high grade HPV-Erkrankung mit dem Ziel, das Rezidivrisiko zu vermindern.
Medical Care Criteria Committee des New York State Department of Health Aids Institute 2018
„Behandler_innen sollten die 9-valente HPV-Impfung mit 3 Dosen (0, 2 und 6 Monate) allen HIV-Positiven im Alter von 9 bis 26 Jahren empfehlen unabhängig von CD4-Zahl, früherem zervikalem oder analem PAP-Testergebnis, HPV-assoziierten Veränderungen oder HPV-Läsionen in der Vorgeschichte. (A3)“
EACS (European AIDS Clinical Society) 2018
Alle Menschen mit HIV bis zum Alter von 26 Jahren/MSM bis zum Alter von 40 Jahren mit dem 9valenten Impfstoff impfen. Wenn eine HPV-Infektion manifest ist, ist der Effekt der Impfung fraglich.
Erste Daten
Zum Einsatz der HPV-Impfung bei HIV-Patienten gibt es weniger Daten, da in den frühen Wirksamkeitsstudien HIV-Patienten ausgeschlossen wurden. Speziell MSM würden von der Impfung profitieren, da bei Ihnen eine hohe Inzidenz an HPV-Infektionen vorliegen und die Analkarzinome häufiger als bei MSW vorkommen. In Verbindung mit der HIV-Infektion sind 9 Immunobridging-Studien (s.o.) mit 1.500 Patienten bekannt (keine klinischen Endpunkte). Zusammengefasst zeigen diese eine gute Immunantwort auf die Impfung, wenig Lokalreaktionen (ISR) und keine Auswirkung auf den Verlauf der HIV-Infektion (Übersicht: https://www.eurosurveillance.org/content/10.2807/1560- 7917.ES.2019.24.7.1700857). So wurde bspw. in der ACTG 5240 eine ausreichend hohe Rate an Serokonversionen gegen HPV-6, -11, -16, -18 bei 13-45-jährigen Frauen gezeigt.3 Dennoch gibt es bisher nur in England und den USA eine klare Empfehlung, HIV-positive Menschen gegen HPV zu impfen. (https://ecdc.europa.eu/sites/portal/files/documents/hpv-public-consultation-1-April-2019.pdf, https://www.hivguidelines.org/sti-care/hpv-infection/ ). Prospektive Studien bei HIV-Patienten sind begonnen worden (NCT00941889 [Kondylome] und NCT02087384 [HGAIN]).
Impfen gegen Rezidive
Obwohl der nanovalente Impfstoff am besten prophylaktisch wirksam ist, gibt es Berichte über den sekundär präventiven Einsatz (nach Entfernung der Kondylome oder CIN). Die Effektivität in Bezug auf das Wiederauftreten der CIN lag mit 61% unter dem der prophylaktischen Studien.4 Bei MSM konnte in einer retrospektiven Studie eine 50% Reduktion der HGAIN nach HPV-Impfung und HGAIN-Entfernung gezeigt werden.5 Die Impfung kann sogar als Therapie einer HPV-induzierten Läsion im Einzelfall wirksam sein (z.B. bei therapieresistenten Verrucae oder orale Kondylomen).
Dabei ist der Impfstoff umso schlechter wirksam, je älter der Patient, je häufiger er HPV-infiziert und je ausgeprägter die Immunsuppression ist. Therapeutische Impfstoffstudien mit den Proteinen E7 und E7 sind in der Prüfung. Eine Phase II-Studie bei 35 MSM mit HIV-Infektion und Analkarzinomen konnte die Sicherheit zeigen.6
HPV-Impfstoff
Zur Impfung stehen inzwischen mehrere Präparate zur Verfügung (https://www.uptodate.com/contents/human-papillomavirus-vaccination). Durchsetzen wird sich der nanovalente Impfstoff Gardasil® 9. Er beinhaltet das L1-Protein des HPV mit den Typen: 6, 11, 16, 18, 31, 33, 45, 52 und 58. L1 ist das Hauptstrukturprotein der äußeren Hülle von HPV. Das in vitro hergestellte Protein ist allein ausreichend immunogen wirksam.
Der Impfstoff ist zugelassen zur aktiven Immunisierung von Personen ab einem Alter von 9 Jahren gegen folgende HPV-Erkrankungen: Vorstufen maligner Läsionen und Karzinome, die Zervix, Vulva, Vagina und den Anus betreffen und die durch die Impfstoff-HPV-Typen verursacht werden; Genitalwarzen (Condylomata acuminata), die durch spezifische HPV-Typen verursacht werden. In klinischen Studien wurde die prophylaktische Wirksamkeit erst bei Mädchen und Frauen, dann aber auch bei Jungs und Männern nachgewiesen.2
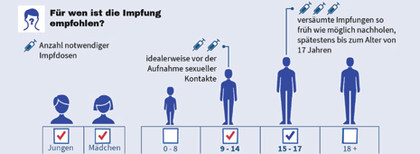
Momentan
sieht die STIKO-Empfehlung wie folgt aus: Für
Mädchen und Jungs im Alter von 9 bis 14 Jahren mit zwei Impfungen im
Abstand von mindestens 5 Monaten. Wenn die erste HPV-Impfung im Alter
von 15 Jahren oder älter verabreicht wird, sind insgesamt drei
Impfungen notwendig. Eine Nachholimpfung sollte bis zum Alter von 17
Jahren erfolgen. Die Antikörpertiter-Antwort ist in jungen Jahren am
höchsten. In klinischen (Immuno-)Bridging-Studien wird bei einer
Übereinstimmung der Immunantwort, die unter bestimmten Bedingungen
erreicht wurde, auf eine Übereinstimmung bei der Wirksamkeit unter
anderen Bedingungen (z.B. Veränderung des Herstellungsprozesses,
zusätzliche Impfungen und/oder Populationen) geschlossen. Die
Nichtunterlegenheit der Immunantwort für den nanovalenten Impfstoff
für Männer (16-26 Jahre) im Vergleich zu Frauen (16-26 Jahre)
konnte gezeigt werden (www.cdc.gov/mmwr/volumes/65/wr/mm6549a5.htm).
Inzwischen hat die FDA Gardasil 9 für Männer und Frauen von 27 bis
45 Jahren empfohlen
(www.fda.gov/news-events/press-announcements/fda-approves-expanded-use-gardasil-9-in-
clude-individuals-27-through-45-years-old).
Die häufigsten
Nebenwirkungen sind
Reaktionen (Rötung, Schwellung und
Schmerz) an der
Einstichstelle, Kopfschmerzen, Muskelschmerzen und Müdigkeit.
HPV-Infektion – Übersicht
 Infektionen
mit Humanen Papillomviren (HPV) manifestieren sich beim Menschen an
Haut und Schleimhäuten, die klinisch als Papillome oder Warzen
imponieren. Dabei sind ausschließlich Epithelzellen betroffen. Ein
kleiner Teil der HPVs, auch Hochrisikotypen (HR) genannt, haben
onkologisches Potential und sind an der Pathogenese des
Zervixkarzinoms, des Analkarzinoms und des Pharynx-Karzinoms
beteiligt. Je nach Lokalisation variiert der Nachweis der HPV-Typen.
Bei 99% aller Zervixkarzinome und 90% aller Analkarzinome werden
Hochrisikotypen, überwiegend HPV-16 und HPV-18 nachgewiesen. Bei
HIV-Patienten mit Immunsuppression ist das Risiko einer
persistierenden
Infektionen
mit Humanen Papillomviren (HPV) manifestieren sich beim Menschen an
Haut und Schleimhäuten, die klinisch als Papillome oder Warzen
imponieren. Dabei sind ausschließlich Epithelzellen betroffen. Ein
kleiner Teil der HPVs, auch Hochrisikotypen (HR) genannt, haben
onkologisches Potential und sind an der Pathogenese des
Zervixkarzinoms, des Analkarzinoms und des Pharynx-Karzinoms
beteiligt. Je nach Lokalisation variiert der Nachweis der HPV-Typen.
Bei 99% aller Zervixkarzinome und 90% aller Analkarzinome werden
Hochrisikotypen, überwiegend HPV-16 und HPV-18 nachgewiesen. Bei
HIV-Patienten mit Immunsuppression ist das Risiko einer
persistierenden
Infektion und damit auch das Risiko der Neoplasie
erhöht.
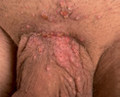
Die mukokutanen Typen 6 und 11 verursachen über 90% aller Condylomata acuminata. Klinisch imponieren exophytische Papillome, die überwiegend sexuell übertragen werden (Abb.).
Das Lebenszeitrisiko beträgt etwa 10%. Nach einer Inkubationszeit von 1 bis 8 Monaten wird die Infektion klinisch manifest, innerhalb von 3 bis 6 Monaten kommt es zur Immunreaktion, die entweder in einer klinischen Remission oder in einer meist rezidivierenden Erkrankung endet. Die Spontanheilungsrate nach 4 Monaten beträgt ca. 30%. Bei gleichzeitig bestehender HIV-Infektion, insbesondere bei niedrigen CD4-Zahlen liegt diese Rate deutlich geringer.
Orale HPV-Infektionen sind bei Gesunden selten und meist transient. Klinisch zeigen sie sich als hautfarbene bis rötliche, filiforme bis papillomatöse Hautveränderungen. Sie kommen gehäuft bei MSM, HIV-Infektion mit niedrigen CD4-Zellen und bei analen Kondylomen vor und verlaufen ausgesprochen therapieresistent.
Penile und anale intraepitheliale Neoplasien (PIN und AIN) sind Vorstufen des HPV-assoziierten Penis- und Analkarzinom. Die größte Assoziation besteht mit HPV 16 (HGAIN). Mit der hochauflösenden Anoskopie können diese Veränderungen in einem frühen klinischen Stadium diagnostiziert werden. Bei MSM ist das Risiko an einem Analkarzinom zu erkranken, 5-30x so hoch (siehe auch https://www.awmf.org/leitlinien/detail/ll/055-007.html).
Bei der Therapie der HPV-assoziierten Läsionen werden überwiegend destruierende Verfahren empfohlen. Entweder operativer Abtragung oder Entfernung durch Laser. Die Möglichkeit der lokalen Immuntherapie besteht mit Imiquimod. Problem bei der Therapie der Kondylome ist weniger die Entfernung, sondern die hohe Rate an Rezidiven.
1 Veyer D, AIDS 2018, #TUPEB056
2 Takia a, Bundesgesundheitsbl 2018. doi.org/10.1007/s00103-018-2791-2
3 Kojic EM, AIDS 2012, #WEAB0203
4 Joura EA, BMJ 2012: 1401. doi.org/10.1136/bmj
5 Swedish KA, CID 2012, 54(7):891-8. doi: 10.1093/cid/cir1036
6 Anderson JS. J AIDS 2009, 52:371-81. doi: 10.1097/QAI.0b013e3181b7354c











 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
