Andreas Osterman, München
HIV-Suchteste in Zeiten der PrEP Neue Steine auf dem Weg zur Diagnose
In den letzten 30 Jahren entwickelte sich weltweit nicht nur die Epidemiologie der HIV-Pandemie, sondern parallel mit ihr auch diagnostische HIV-Teste, um diese zu erfassen und zu beeinflussen. Die neueste Herausforderung für diese Testsysteme stellt die Diagnose bzw. der Ausschluss einer HIV-Infektion unter Einnahme einer Prä-Expositions-Prophylaxe (PrEP) oder einer Post-Expositions-Prophylaxe (PEP) dar. Um diese neue Situation einschätzen zu können, kann es hilfreich sein, sich die historische Entwicklung von Aufbau und Funktion gängiger HIV-Suchteste vor Augen zu halten (Tab. 1).1
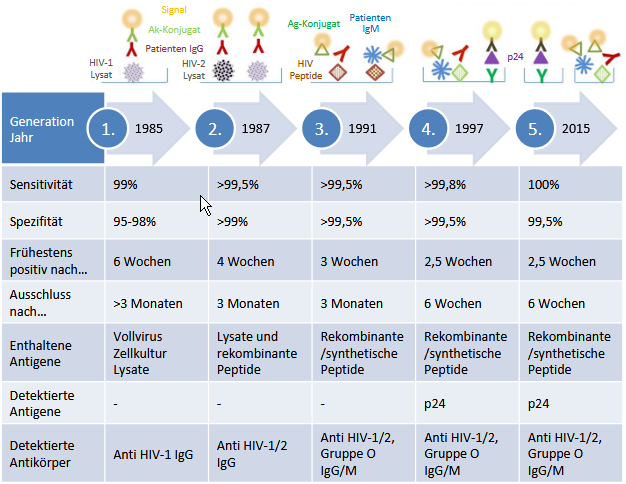
Tab. 1 Schematische Darstellung der Evolution, Aufbau und Charakteristika von HIV-Suchtesten (adaptiert nach1)
Test-Generationen
Bei den ersten serologischen Testsystemen der 1980er Jahre, die mit einer hohen Sensitivität für die Sicherheit von Blutprodukten entwickelt wurden, handelte es sich um indirekte Nachweisverfahren, die nur IgG Antikörper im Patientenserum detektierten, welche sich gegen HIV-1 Lysate aus Zellkulturen richteten. Die durch die Verunreinigung mit zellulären Antigenen verursachten, hohen falsch-positiv Raten bei der Untersuchung von Niedrigrisiko-Popula-tionen führten zur Entwicklung der 2. Generation von Testsystemen. Hierbei wurden rekombinante und synthetische Virus-Antigene als Testbasis eingeführt, um die Spezifität in der Anwendung zu erhöhen. Durch die Detektion von IgG Antikörpern gegen p24, aber auch Antigenen von HIV-2, konnte zudem eine Verbesserung der Sensitivität erzielt werden, sodass sich das diagnostische Fenster einer akuten HIV Infektion (AHI) von mehr als 12 Wochen auf bis zu 6 Wochen2 post infektionem verkürzte. Anfang der 1990er konnte diese Zeitspanne durch den veränderten Testaufbau (Sandwich-Test) und den gleichzeitigen IgM Nachweis weiter auf ca. 3-4 Wochen reduziert werden (HIV-Suchteste der 3. Generation). Zur damaligen Zeit erlaubte bereits der separat durchzuführende p24-Antigentest einen serologischen Nachweis der HIV-Infektion frühestens 2-3 Wochen nach Infektion. Erst 1997 wurde diese Antigenkomponente neben dem Antikörpernachweis in sogenannte 4. Generationstest integriert. Es ist hervorzuheben, dass mit dem Wechsel von 3. auf 4. Generation die Testhersteller auf die Detektion von anti-p24-Antikörpern verzichten (mussten). Ist ein Testsystem in der Lage die Signale aus den Antigen- bzw. Antikörper-Reaktionen getrennt auszuwerten, spricht man von einem HIV-Test der 5. Generation.
HIV-Antigene
In der folgenden Darstellung der Testbestandteile soll primär auf den Nachweis von HIV-1 eingegangen werden.
Aus den anfänglichen Vollvirus-Zellkultur-Lysaten kristallisierten sich bis heute einige wenige, nun rekombinant/synthetisch hergestellte Antigene heraus, die eine hohe Sensitivität und Spezifität aufweisen, sich dennoch in ihren Eigenschaften zum Nachweis HIV-spezifischer Antikörper unterscheiden (Tab. 2):
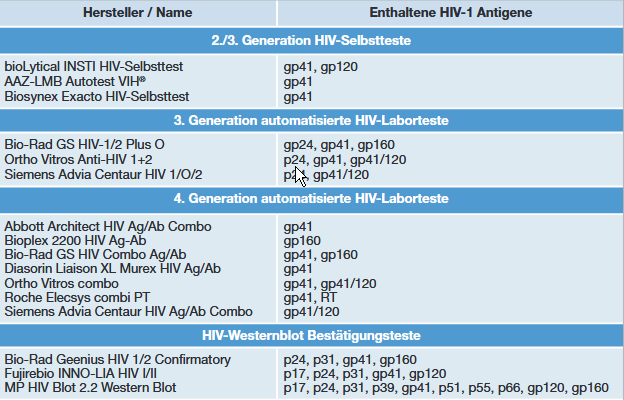
Tab. 2 Übersicht der in verschiedenen HIV-Test Formaten enthaltenen HIV-1 Antigen zum Nachweis HIV-1 spezifischer Antikörper (adaptiert nach22 Branson B)
Das HIV-1 Envelope Gen („env“) kodiert für das gp160 Protein, welches teilweise durch zelluläre Proteasen in die aktiven Formen gp41 und gp120 gespalten wird.3 Diese sind für das Eindringen des Virus über den CD4-Rezeptor verantwortlich. Da die Prozessierung von gp160 jedoch nicht zuverlässig an jedem Molekül vonstatten geht, richten sich sehr viele gebildete Antikörper auch gegen die inaktive Form, das gp160. Diese Antikörper sind im serologischen Verlauf der unbehandelten AHI als erstes nachweisbar und persistieren am längsten. Das p24-Protein ist im Gruppen-spezifischen Antigen („gag“) kodiert und bildet im reifen HIV-Partikel das Kapsidprotein aus. Dieses nicht-glykosilierte Protein wird während der Virusreplikation in großen Mengen gebildet und ist in der Diagnostik über einen Zeitraum von ca. 4 Wochen nachweisbar.4 Der Nachweis von Antikörpern gegen p24 kann im Verlauf einer Infektion wieder „verblassen“. Im Gegensatz hierzu werden Enzyme des Polymerase Gens („pol“) von vornherein in geringerer Menge produziert und spielen in der Suchtest-Diagnostik aufgrund der geringeren und relativ späten Antikörperantwort eine untergeordnete Rolle. Daher sind sie in HIV-Suchtesten der 4. Generation nicht vertreten, werden jedoch in Westernblot-Bestätigungstesten angewendet.
Diese Kenntnis über testtheoretische Eigenschaften der verschiedenen HIV-Suchteste ist notwendig, um das Auftreten verschiedener Phänomene in der Diagnostik der HIV-Infektion zu verstehen.
2. DIAGNOSTISCHES FENSTER
Bereits in HIV-Suchtesten der 3. Generation war das Auftreten eines zweiten diagnostischen Fensters möglich, was im Verlauf einer AHI zu einem erneut negativen Testergebnis am Übergang der IgM- zur IgG-Detektion führen konnte. Ein ähnliches Phänomen ist bei 4. Generationstesten möglich.5 Hierbei wird das Testergebnis erneut negativ, nachdem die p24-Antigenkomponente unter die Nachweisgrenze fällt, bevor die Antikörperkomponente die Nachweisgrenze überschreitet. Diese zweiten diagnostischen Fenster können unabhängig von einer antiretroviralen Therapie (ART) auftreten und führen nur zu einer intermittierenden Negativität der HIV-Suchtesten.
SEROREVERSION NEUGEBORENER
Bei vertikal infizierten Kindern HIV positiver Mütter kann es im Verlauf der ersten Lebensjahre ebenfalls zu einem erneut negativen HIV-Suchtestergebnis kommen.6 Wird früh nach der Geburt dem kindlichen Immunsystem durch eine ART die Möglichkeit der eigenständigen Reifung am HIV-Antigen genommen, bleibt eine kindliche Antikörperbildung aus. Der Rückgang der maternalen Antikörper im kindlichen Blut, kann dann zu einer anhaltenden Seroreversion führen.
Grenzen der Tests
Vor wenigen Jahren wandelte sich die Indikation der ART hin zu einem sofortigen Therapiebeginn auch schon während einer AHI.7 Eine verzögerte Antikörper-Evolution und die Re-Evolution einer bereits ausgebildeten Antikörperantwort stellt 4. Generationsteste vor neue Probleme.8 Diese werden durch eine supprimierte Antigen-Synthese begründet, welche wiederum es selbst 4. Generationstesten schwierig macht über die p24 Antigenkomponente eine AHI nachzuweisen. Interessanterweise stellt sich unter diesen neuen Voraussetzungen ein (oben bereits erwähnter) Entwicklungsschritt in der Evolution vom Dritt- zum Viertgenerationstest möglicherweise als nicht vorhergesehener Nachteil dar:
In einer großen Studie von de Souza et al.9, deren Teilnehmer eine ART im Durchschnitt 19 Tagen nach HIV-Exposition begannen, konnte fast die Hälfte (46%) der Patienten nicht serokonvertieren (oder nur vorübergehend vor Eintritt einer Seroreversion). In der Studie waren die Antigen/Antikörper Immunoassays der vierten Generation die empfindlichsten für den Nachweis einer AHI vor Beginn der ART; die Antikörper detektierenden Testsysteme der 3. Generation waren jedoch während der Behandlung überlegen.
Zurück zur 3. Generation?
Als Ursache für diese Beobachtung nennen die Autoren die Tatsache, dass die in ihrer Studie verwendeten 3. Generationsteste eine größere Breite an Antigenen aufweisen (gp160 und p24) gegenüber den 4. Generationstesten, die nur Antikörper gegen gp41 nachweisen. Diese Ende der 1990er gewollte Verschmälerung der in 4. Generationstesten enthaltenen Antigene könnte nun in der Entwicklung der nächsten Generation von HIV-Suchtesten wieder revidiert werden müssen.
Natürlich ist es eine ungewöhnliche Situation, bei einem Patienten unter ART einen erneuten HIV-Suchtest durchzuführen. Dennoch können verschiedene Gründe, wie Zweifel am Testergebnis oder Re-Testung in einem neuen medizinischen Umfeld, individuell nachvollziehbar sein. Seit jüngster Zeit gibt es zudem eine neue Situation, in der sogar explizit empfohlen wird therapierte Patienten während AHI mittels HIV-Suchtest zu untersuchen: Die Diagnose einer HIV-Infektion unter PrEP-Einnahme! Wie wahrscheinlich eine sogenannte Durchbruchsinfektion unter PrEP-Einnahme ist, hängt maßgeblich von der Compliance des Patienten ab.10 Dennoch wird sie als selten angesehen und ist nur in den wenigsten Fällen mit dem Vorliegen gegen PrEP-Wirkstoffe resistenter Viren assoziiert.11
Verzögerte SEROKONVERSION
Auch unter PrEP kommt es zu einer verzögerten Serokonversion im Falle einer Durchbruchsinfektion.12 Diese wird jedoch für 4. Generationsteste bisher nicht als so dramatisch wie in den oben beschriebenen Studien mit „früher Therapie“ dargestellt13, wenn es darum geht akute Infektionen im Verlauf sensitiv nachzuweisen. Weitere Studien werden erst zeigen müssen, ob auch hier Seroreversionen eine Rolle spielen können. Zudem muss beobachtet werden, wie häufig in solchen Fällen das p24-Antigen Signal unterhalb der Nachweisgrenze von 4. Generationstesten liegt – was bereits ab Viruslasten unter 104-5 Kopien/ml der Fall ist – und so andauernde, falsch negative Ergebnisse verursachen kann.14
Die beobachtete Verzögerung der Serokonversion unter PrEP hat jedoch einen signifikanten Einfluss auf die Sensitivität von HIV-Suchtesten der 2. und 3. Generation. Auch hierzulande spielen diese rein Antikörper-basierten Testsysteme noch eine wichtig Rolle, da sie erst kürzlich in Form von sogenannten HIV-Selbsttesten freiverkäuflich für jedermann zugänglich gemacht wurden.
HIV-Selbstteste
In Deutschland werden derzeit drei verschiedene HIV-Selbstteste auf der Homepage der Deutschen Aidshilfe aufgeführt. Die wichtigsten Charakteristika dieser drei Produkte werden in Tabelle 3 zusammengefasst.15 Die Erkenntnisse von de Souza aus der Performance von 2. und 3. Generationstesten bei Patienten während einer frühen ART, würden erwarten lassen, dass HIV-Selbstteste eine AHI unter PrEP mindestens genauso gut (bzw. schlecht) wie ein HIV-Suchtest der 4. Generation detektieren können. Donnel et al.16 zeigen jedoch in Ergebnissen der „The Partners PrEP Study“ eindrücklich, wie die verzögerte Serokonversion der Sensitivität von HIV-Selbsttesten Probleme bereitet: Bei monatlicher Testung konnten Durchbruchsinfektionen in dieser Studie durch HIV-Selbsttest nur zu 36% bereits in der ersten Probe nach Infektion nachgewiesen werden (gegenüber 51% im Placebo-Arm). Wurde der Zeitraum der Testung nach HIV-Infektion auf 100 Tage erweitert (entspricht in etwa der empfohlenen Wartezeit von 3 Monaten nach letzter Exposition bei HIV-Selbsttesten) konnten immer noch 17% der PrEP Patienten mit nachweisbarem TDF-Spiegel durch HIV-Selbstteste nicht diagnostiziert werden. Gegenüber der Placebo-Gruppe bedeutet dies eine signifikante Risikoerhöhung für ein falsch-negatives Ergebnis unter PrEP (Odds ratio = 7,18). Im Vergleich zu laborgestützten Testen wird bei Selbsttesten ein deutlich geringeres Probenvolumen eingesetzt, was sicher auch einen Teil der hier beobachteten verminderten Sensitivität von Selbsttesten verursacht.
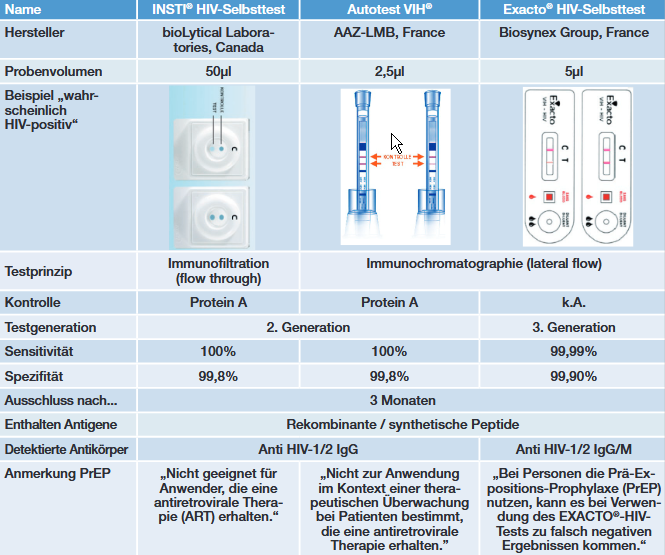
Tab. 3 Übersicht der Charakteristika verschiedener in Deutschland erhältlicher HIV-Selbstteste
Cave: Falsch-positiv
Der Aspekt „Selbst“ ist bei diesen Testsystemen sicherlich ein entscheidender Vorteil in der Landschaft der HIV-Diagnostik, der HIV-Testung sehr viel mehr Menschen zugänglich macht. „Selbst“ bedeutet jedoch auch, dass der Patient den Test selbst korrekt durchführen und interpretieren muss. Die Hersteller von Autotest VIH® geben beispielsweise an, dass in der Laiendurchführung ca. 1% der Teste ungültig waren und ein weiteres Prozent korrekter Testergebnisse durch den Laien falsch interpretiert werden. Dies in Zusammenhang mit einer nicht 100%igen Spezifität der HIV-Selbstteste kann zu einer entsprechenden falsch-positiv Rate führen, die in der „The Partners PrEP Study“17 beispielsweise mit ca. 0,16 angegeben wird. In Ländern mit im Vergleich niedrigerer HIV-Inzidenz kann dies dazu führen, dass generell ein positiver HIV-Selbsttest wahrscheinlicher ein falsch-positives Ergebnis darstellt18, als eine Durchbruchsinfektion unter PrEP anzeigt („falsch-positiv Paradoxon“).
Daher ist es nicht zu vernachlässigen, dass bei HIV-Selbsttesten auch der Patient „selbst“ die korrekte Indikation (letzter HIV-Risikokontakt vor mehr als drei Monaten) und vor allem Kontraindikationen des verwendeten HIV-Selbsttests kennt. Für den Erhalt eines korrekten Testergebnisses ist zu beachten, einen HIV-Selbsttest nicht unter antiretroviraler Therapie zu verwenden. Bemerkenswerterweise wird nur vom Hersteller des Exacto® HIV-Selbsttest in diesem Zusammenhang explizit auch die Präexpositionsprophylaxe (PrEP) genannt.
Kein Selbsttest unter PrEP
Aufgrund der zunehmenden Unsicherheit von HIV-Suchtesten bei Patienten mit AHI unter PrEP-Einnahme ist diesen von einer Selbsttestung mit frei verkäuflichen 2./3. Generationstesten ausdrücklich abzuraten. Zur Feststellung/Ausschluss einer Durchbruchsinfektion ist der PrEP-Patient explizit auf die leitliniengerechte19 Veranlassung einer Untersuchung mittels automatisiertem 4. Generationstest alle drei Monate hinzuweisen. In einer Notfallsituation – beispielsweise nach Nadelstichverletzung an einem unter PrEP stehenden Indexpatienten und Frage nach der Indikation einer Postexpositionsprophylaxe – oder bei klinischem Verdacht auf eine Durchbruchsinfektion eines PrEP-Patienten muss neben dem HIV-Suchtest (Viertgenerationstest!) ein Nachweis von HIV-RNA angestrebt werden. Hier ist die zunehmende Verbreitung von Random-access Geräten ein Vorteil, die eine zeitnahe Testung erlauben, sofern der verwendete Nukleinsäure-Amplifikationstest für eine Untersuchung zur Erstdiagnose von HIV zugelassen ist. Dennoch stoßen auch diese Nachweisverfahren in Zeiten der PrEP an ihre Grenzen.20,21
1 Alexander TS. Clin Vaccine Immunol. 2016 Apr 4;23(4):249-53
2 Fiebig EW, Wright DJ, Rawal BD, Garrett PE, Schumacher RT, Peddada L, Heldebrant C, Smith R, Conrad A, Kleinman SH, Busch MP. AIDS. 2003 Sep 5;17(13):1871-9
3 Tomaras GD, Yates NL, Liu P, Qin L, Fouda GG, Chavez LL, Decamp AC, Parks RJ, Ashley VC, Lucas JT, Cohen M, Eron J, Hicks CB, Liao HX, Self SG, Landucci G, Forthal DN, Weinhold KJ, Keele BF, Hahn BH, Greenberg ML, Morris L, Karim SS, Blattner WA, Montefiori DC, Shaw GM, Perelson AS, Haynes BF. J Virol. 2008 Dec;82(24):12449-63.
4 Busch MP, Satten GA. Am J Med. 1997 May 19;102(5B):117-24
5 George CR, Robertson PW, Lusk MJ, Whybin R, Rawlinson W. J Clin Microbiol. 2014 Nov;52(11):4105-8
6 Eberle J, Notheis G, Blattmann C, Jung J, Buchholz B, Korn K, Kulozik AE, Schnitzler P. AIDS. 2010 Nov 13;24(17):2760-1
7 INSIGHT START Study Group, Lundgren JD, Babiker AG, Gordin F, Emery S, Grund B, Sharma S, Avihingsanon A, Cooper DA, Fätkenheuer G, Llibre JM, Molina JM, Munderi P, Schechter M, Wood R, Klingman KL, Collins S, Lane HC, Phillips AN, Neaton JD. N Engl J Med. 2015 Aug 27;373(9):795-807
8 Manak MM, Jagodzinski LL, Shutt A, Malia JA, Leos M, Ouellette J, Akapirat S, Colby DL, Phanuphak N, Eller LA, Robb ML, de Souza M, Ananworanich J, Peel SA; RV254/SEARCH010 and the RV217 Study Teams. J Clin Microbiol. 2019 Sep 24;57(10)
9 de Souza MS, Pinyakorn S, Akapirat S, Pattanachaiwit S, Fletcher JL, Chomchey N, Kroon ED, Ubolyam S, Michael NL, Robb ML, Phanuphak P, Kim JH, Phanuphak N, Ananworanich J; RV254/SEARCH010 Study Group. Clin Infect Dis. 2016 Aug 15;63(4):555-61.
10 Serota DP, Rosenberg ES, Lockard AM, Rolle CM, Luisi N, Cutro S, Del Rio C, Siegler AJ, Sanchez TH, Sullivan PS, Kelley CF. Clin Infect Dis. 2018 Aug 31;67(6):965-970.
11 Gibas KM, van den Berg P, Powell VE, Krakower DS. Drugs. 2019 Apr;79(6):609-619.
12 Donnell D, Ramos E, Celum C, Baeten J, Dragavon J, Tappero J, Lingappa JR, Ronald A, Fife K, Coombs RW; Partners PrEP Study Team. AIDS. 2017 Sep 10;31(14):2007-2016
13 Delaugerre C, Antoni G, Mahjoub N, Pialoux G, Cua E, Pasquet A, Hall N, Tremblay C, Cotte L, Capitant C, Chaix ML, Meyer L, Molina JM; IPERGAY Study Group. J Infect Dis. 2017 Aug 1;216(3):382-386
14 Zucker J, Carnevale C, Rai AJ, Gordon P, Sobieszczyk ME. J Acquir Immune Defic Syndr. 2018 Jun 1;78(2):e11-e13
15 www.aidshilfe.de
Unitaid,
World Health Organization. Market and technology landscape: HIV rapid
diagnostic tests for self-testing, 4th edition. Geneva: Unitaid;
2018.
www.autotest-vih.eu
www.hivtest-exacto.de
www.hivheimtest.de
16 Donnell D, Ramos E, Celum C, Baeten J, Dragavon J, Tappero J, Lingappa JR, Ronald A, Fife K, Coombs RW; Partners PrEP Study Team. AIDS. 2017 Sep 10;31(14):2007-2016
17 Ndase P, Celum C, Kidoguchi L, Ronald A, Fife KH, Bukusi E, Donnell D, Baeten JM; Partners PrEP Study Team. PLoS One. 2015 Apr 17;10(4):e0123005
18 Stekler JD, Violette LR, Niemann L, McMahan VM, Katz DA, Baeten JM, Grant RM, Delaney KP.
Open Forum Infect Dis. 2018 Sep 26;5(9):ofy197
19 Deutsch-Österreichische Leitlinien zur HIV-Präexpositionsprophylaxe Klassifikation: S2k AWMF-Register-Nr.: 055-008
20 Smith DK, Switzer WM, Peters P, Delaney KP, Granade TC, Masciotra S, Shouse L, Brooks JT. Open Forum Infect Dis. 2018 Jul 21;5(8):ofy180
21 Hoornenborg E, Prins M, Achterbergh RCA, Woittiez LR, Cornelissen M, Jurriaans S, Kootstra NA, Anderson PL, Reiss P, de Vries HJC, Prins JM, de Bree GJ; Amsterdam PrEP Project team in the HIV Transmission Elimination AMsterdam Consortium (H-TEAM). Lancet HIV. 2017 Nov;4(11):e522-e528
22 Bernard Branson, IAS2019, 21.-24. Juli 2019, Mexico City











 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
