Ramona Pauli, München
COVID-19 Prophylaxe*
Bereits in den ersten Wellen der weltweiten SARS-CoV-2-Infektion mit Wildtyp- und Delta-Virus wurden die Risikofaktoren für einen schweren Verlauf einer Infektion identifiziert. Diese scheinen auch für die Omikron-Variante zu gelten. Vulnerabel sind insbesondere Menschen mit:
Risikofaktor HIV-Infektion
Patient*innen mit einer relevanten Beeinflussung des Immunsystems (z.B. durch eine onkologische Erkrankung, Chemotherapie, Immuntherapie oder Immundefekt, insbesondere bei B-Zell-Depletion) haben ein erhöhtes Risiko für einen schweren Verlauf sowie für ein humorales Impfversagen. Bei der HIV-Infektion geht man bei einer CD4-Zellzahl <200/µl von einem relevanten Immundefekt aus. Weitere Faktoren, die auf eine eingeschränkte Immunantwort hinweisen können, sind ein Nadir in diesem Bereich sowie Aids in der Vorgeschichte.
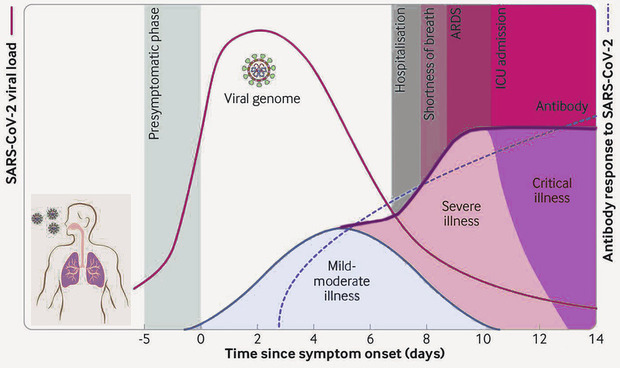
Abb. 1 Verlauf einer SARS-CoV-2 Infektion
Quelle: EMA
PrEP, PEP und Therapie
Zur Prävention eines schweren Verlauf einer COVID-Erkrankung stehen verschiedene Optionen zur Verfügung. Diese entsprechenden Medikamente wurden alle bei Menschen mit einem erhöhten Risiko für eine schwere COVID-19 Erkrankung geprüft. Nur für diese Gruppe ist der Nutzen belegt, nur für diese Gruppe sind sie zugelassen und für diese Gruppe sollten sie eingesetzt werden. Derzeit gibt es drei Ansätze:
- Präexpositionsprophylaxe, wenn der Patient*in auf die 3fach-Impfung aufgrund einer schweren Immundefizienz keinen Schutz durch neutralisierende Antikörper entwickelt, durch wiederkehrende intravenöse oder subkutane Gabe von monoklonalen Antikörpern.
- Postexpositionsprophylaxe, wenn der Patient*in einen Kontakt mit einem Infizierten hatte, durch einmalige intravenöse oder subkutane Gabe monoklonaler Antikörper möglichst früh nach der Exposition.
- Therapie, wenn der Patient*in mit nachgewiesener Infektion und ohne/milden Symptomen, möglichst früh (1 Woche) mit einmalig intravenös oder subkutan mit monoklonalen Antikörpern bzw. oral über mehrere Tage mit direkt antiviralen Substanzen behandelt wird.
Gesetzliche Vorgaben
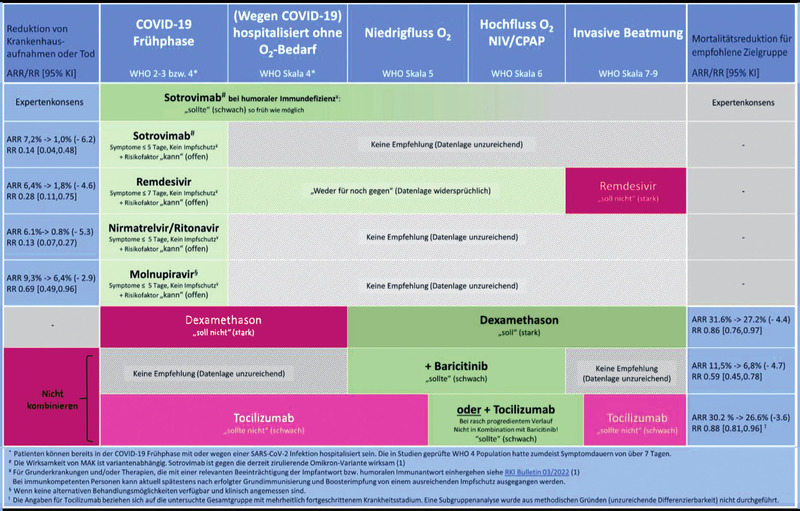
Zur Prävention stehen monoklonale Antikörper und antivirale orale Medikamente zur Verfügung. Die Präparate wurden vom Bundesministerium für Gesundheit (BMG) angekauft und ihr Einsatz wird vom Ministerium geregelt. Der Bezug, die Abgabe und die Anwendung sind nur zum Zweck und nach Maßgabe der vom BMG festgelegten Bedingungen und Indikationen in aktueller Fassung zulässig. Diese werden von der Arbeitsgruppe COVIRIIN des RKI beurteilt. Die Informationen werden auf den Internetseiten des Paul-Ehrlich-Instituts (PEI), www.pei.de/coronavirus-biomedizinische-arzneimittel, veröffentlicht und – sofern erforderlich – aktualisiert. Kürzlich wurde auch die deutsche S3-Leitlinie zu COVID-19 aktualisiert (Abb. 2). www.awmf.org/leitlinien/detail/ll/ 113-001LG.html
Risikofaktoren
Risikofaktoren für einen schweren Verlauf einer COVID-19-Erkrankung sind laut RKI derzeit insbesondere:
- Alter (mit stetig steigendem Risiko für einen schweren Verlauf ab etwa 50 bis 60 Jahren)
- Adipositas (BMI >30)
- Chronische Vorerkrankungen:
- Trisomie 21
- Herz-Kreislauf-Erkrankungen
- Lungenerkrankungen
- Diabetes mellitus Typ 1 und 2
- Nierenerkrankungen speziell bei Dialysepflicht
- Lebererkrankungen
- Neurologisch-psychiatrische Erkrankungen, Demenz
- Immunsuppression
- Medikament-bedingt (z.B. Cortison, Methotrexat)
- Tumorerkrankungen
- Zustand nach Transplantation
- HIV-Infektion mit CD4 <200/µl
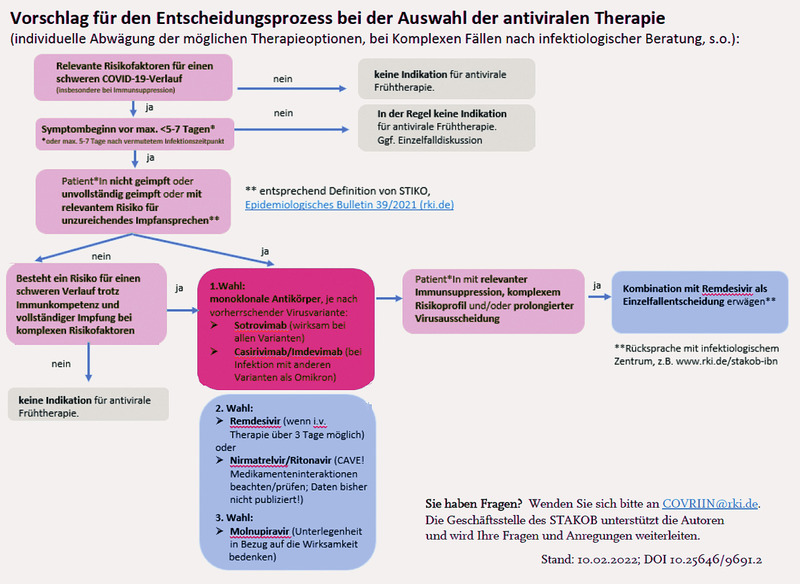
In Deutschland können verschiedene monoklonale Antikörper eingesetzt werden, entscheidend ist der frühzeitige Einsatz. Das Bundesministerium für Gesundheit hat im April 2021 durch die Monoklonale-Antikörper-Verordnung (MAKV) auch für die niedergelassene Ärzteschaft in Deutschland die Möglichkeit vorgesehen, SARS-CoV-2 infizierte Patienten mit einem Risiko für einen schweren Verlauf zu behandeln. Nach der Diagnose streng genommen hier „SARS-CoV-2“ und mindestens einem bestehenden Risikofaktor für einen schweren Verlauf kann der Arzt die monoklonalen Antikörper entweder über die Stern- und Satellitenapotheken bestellen oder den Patienten an ein Behandlungszentrum schicken, das die Therapie mit monoklonalen Antikörpern durchführt. Nach einer kurzen Überwachung auf die Verträglichkeit der Behandlung kann der Patient die Ambulanz verlassen.
Orale antivirale Medikamente können Ärztinnen und Ärzte verschreiben nach Zulassung und nach Maßgabe der Empfehlungen der Fachgesellschaften. Diese werden auf den Internetseiten des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM), www.bfarm.de/covid-19-arzneimittel, veröffentlicht und – sofern erforderlich – aktualisiert.
PrEP und PEP
Damit ist die regelhafte Gabe von monoklonalen Antikörper vor Risikokontakt bzw. die Gabe nach Kontakt mit einem Infizierten. Derzeit ist kein Medikament zur Prä- und Postexpositionsprophylaxe in Deutschland zugelassen. Der monoklonale Antikörper Evusheld® (Tixagevimab/Cilgavimab) wird derzeit von der EMA geprüft und möglicherweise für diesen Einsatz zugelassen werden. Evisheld steht in Deutschland als Notfallreserve zur PrEP (nicht Therapie) zur Verfügung.
Monoklonale Antikörper
Die neutralisierenden monoklonalen Antikörper (mAb) richten sich gegen das Spike-Protein von SARS-CoV-2. Mutationen im Spike-Protein des Virus haben daher auch Einfluss auf die Wirksamkeit dieser Substanzen. Zuverlässige klinische Daten zur Effizienz der Antikörper bei der aktuellen Omikron-Variante stehen nicht zur Verfügung, da die meisten Studien vor der Omikron-Pandemie durchgeführt wurden. In vitro-Untersuchungen geben jedoch einen Hinweis auf das Ausmaß der Einschränkung.
Bei Patient*innen mit Immundefizienz sollten vorzugsweise monoklonale Antikörper eingesetzt werden. Sie sollten so früh wie möglich nach laborchemisch bestätigten Infektion gegeben werden und zwar bei infizierten Risikopatient*innen mit Symptomen innerhalb der ersten 7 Tage, ohne Symptome innerhalb von 3 Tagen nach der positiven PCR.
Sotrovimab
Xevudy®. Quelle GSK
Xevudy®
Sotrovimab (Xevudy®) wurde im Dezember 2021 zugelassen für die Behandlung einer COVID-19-Erkrankung von Erwachsenen und Jugendlichen ab 12 Jahren spätestens fünf Tage nach Symptombeginn, die keine Sauerstoffbehandlung benötigen und ein erhöhtes Risiko für einen schweren Verlauf der Erkrankung haben. Es ist ein humaner monoklonaler Antikörper, der an die Rezeptor-bindenden Domäne des Spike-Proteins von SARS-CoV-2 bindet. Während die neutralisierende Aktivität gegenüber der Delta-Variante uneingeschränkt gegeben ist, deuten die Daten derzeit darauf hin, dass die Neutralisierung gegenüber der Omikron-Variante zwar um den Faktor 16-fach reduziert, jedoch noch gegeben ist.
Die empfohlene Dosis ist eine einzelne intravenöse Infusion von 500 mg Xevudy® innerhalb von 5 Tagen nach Auftreten von COVID-19-Symptomen. Die häufigsten Nebenwirkungen sind Überempfindlichkeitsreaktionen (2%) und infusionsbedingte Reaktionen (1%). Die häufigste schwerwiegende Nebenwirkung war Anaphylaxie (0,05%).
Casirivimab/Imdevimab
Ronapreve®. Quelle Roche
Ronapreve®/Regn-CoV-2
Casirivimab/Imdevimab (Ronapreve®/Regn-CoV-2) erhielt im November 2021 die Zulassung durch die Europäische Arzneimittel-Agentur (EMA) für den therapeutischen und prophylaktischen Einsatz. Das Bundesministerium für Gesundheit (BMG) und das Paul-Ehrlich-Institut (PEI) informierten kürzlich (13.1.2022) über eine stark verminderte Neutralisierungsaktivität und damit geringere Wirksamkeit gegenüber der Omikron-Variante. Das Präparat spielt daher im klinischen Alltag keine Rolle mehr.
Tixagevimab/Cilgavimab
Evusheld®
Die
Antikörper Tixagevimab/Cilgavimab (Evusheld®)
binden an zwei nicht überlappende Regionen des Spike-Proteins von
SARS-CoV-2. In vitro ist die Wirksamkeit von Tixagevimab/Cilgavimab
gegenüber der Omikron-Variante reduziert, aber nicht aufgehoben.
Tixagevimab/Cilgavimab wird in zwei getrennten, unmittelbar
aufeinander folgenden Injektionen
intramuskulär appliziert und
soll über sechs Monate wirken.
Direkt Antivirale Therapie
Mittlerweile stehen auch direkt antivirale Substanzen zur oralen COVID-19 Frühtherapie von Risikopersonen zur Verfügung. Sie hemmen die virale Vermehrung durch Einbau eines „falschen Bausteins“ in das virale RNA-Genom. Indikation ist eine SARS-CoV-2-Infektion und ein erhöhtes Risiko für einen schweren Verlauf. Die Behandlung sollte möglichst früh innerhalb der ersten 5 Tage nach Symptombeginn begonnen werden. Die Wirksamkeit wird ähnlich wie bei den monoklonalen Antikörpern durch Mutationen im Spike-Protein beeinträchtigt.
Nirmatrelvir + Ritonavir

Paxlovid® in Blisterpackung. Quelle Pfizer
Paxlovid®
Nirmatrelvir ist ein Proteasehemmer, es hemmt die virale 3CL-Protease. Sie wird durch Ritonavir geboostert, was durch die gleichzeitige Hemmung von CYP 450 und P-Glykoprotein ein entsprechendes Interaktionspotential aufweist. In der Zulassungsstudie verminderte Nirmatrelvir + Ritonavir (Paxlovid®) bei einem Therapiebeginn innerhalb von 3 Tagen nach Symptombeginn die Hospitalisierungs-/Sterberate um rund 90% gegenüber Placebo (6,5% auf 0,7%). In vitro war die Substanz auch gegen Omikron wirksam.
Indikation ist die Behandlung von nicht-hospitalisierten Patient*innen mit COVID-19 ohne zusätzlichen Sauerstoffbedarf, aber mindestens einem Risikofaktor für einen schweren Verlauf. Die Behandlung sollte innerhalb von drei Tagen eingeleitet werden. Die Dosierung beträgt Nirmatrelvir 300 mg (2 Tabletten) + Ritonavir 100 mg (1 Tablette) zweimal täglich über 5 Tage.
Durch die Kombination mit Ritonavir besteht das Risiko von kritischen Arzneimittelinteraktionen. Die Kombination mit NAOKs beispielsweise kann das Blutungsrisiko relevant erhöhen. Schwangere und stillende Frauen sowie Kinder und Jugendliche wurden in die Zulassungsstudie nicht aufgenommen. Nebenwirkungen sind Beeinträchtigung des Geschmackssinns, Durchfall, Bluthochdruck und Muskelschmerzen.
Molnupiravir
Lagevrio®. Quelle MSD
Lagevrio®
Molnupiravir gehört zur Gruppe der NRTI. Das Prodrug MTP ist ein Nukleotidanalogon von Cytidintriphosphat (CTP) und in seiner tautomeren Form unter anderem auch von Uridintriphosphat (UTP) und konkurriert somit als Substrat der (SARS-CoV-2-)RNA-abhängigen RNA Polymerase. In der Zulassungsstudie verminderte Molnupiravir die Hospitalisierungs-/Sterberate um rund 50% gegenüber Placebo (17,1% auf 7,3%). In vitro war die Substanz auch gegen Omikron wirksam.
Indikation für Molnupiravir (Lagevrio®) ist die Therapie von Erwachsenen mit milder bis max. moderater COVID-19- Erkrankung ohne Sauerstoffbedarf mit Risiko für einen schweren Verlauf. Das Medikament kann auf einem normalen Rezept (KV Muster 16 zulasten Bundesamt Soziale Sicherung) verordnet und über jede Apotheke bezogen werden. Da die Therapie innerhalb von fünf Tagen nach Therapiebeginn begonnen werden muss, ist die Gültigkeitsdauer auf dem Rezept zu vermerken. Die Dosis beträgt 800 mg/d (4 Kapseln a 200 mg) alle 12 Stunden über 5 Tage.
Die Verträglichkeit ist gut. Kontraindikationen sind Schwangerschaft/Stillen, eine GFR <30 ml/Min, Neutrophile <500/µl sowie Thrombozyten <100.000/µl. Nebenwirkungen sind Diarrhoen, Übelkeit, Schwindel, Kopfschmerz, Thrombopenie und Leberschädigung.
Molnupiravir hat nach aktueller Datenlage mutagenes Potenzial. Daher:
- Ausschluss Schwangerschaft, bei Frauen im gebährfähigen Alter. Schwangerschaftstest vor Therapiebeginn
- Sichere Kontrazeption (inkl. mechanischer Barriere) während der Einnahme und bis 4 Tage nachdem Molnupiravir beendet wurde
- Männer sollten während der Behandlung mit Lagevrio und für 3 Monate danach kein Kind zeugen
- Während der Einnahme und bis 4 Tage nachdem Molnupiravir
Weiterführende Informationen
Fachruppe COVRIIN am RKI
https://www.rki.de/DE/Content/Kommissionen/COVRIIN/FG_COVRIIN_node.html
Paul-Ehrlich-Institut
Kassenärztliche Bundesvereinigung
https://www.kbv.de/html/coronavirus.php
Bundesministerium für Gesundheit
https://www.bundesgesundheitsministerium.de/coronavirus.html
*Stand März 2022. Wie bei allen anderen Themen rund um SARS-CoV-2 ist auch hier alles im Fluss, d.h. auf Aktualisierungen ist zu achten.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
