Hartmut Stocker, Berlin
Legionellen und die Legionärskrankheit

Dr. Joseph E. McDade (links) und Dr. Charles C. Shepard, 1977 im Labor der CDC
1976 kommen in Philadelphia tausende Menschen zu einer Feier der 200 Jahre zuvor erklärten Unabhängigkeit der Vereinigten Staaten zusammen. 182 Mitglieder der Pennsylvania American Legion, die für das Ereignis im Bellevue-Stratford Hotel einquartiert waren entwickeln nach dem Fest eine grippeähnliche Erkrankung.
29 von diesen Legionären sterben.1 Im Winter zuvor war ein Influenzavirus aufgetaucht, welches antigenetische Ähnlichkeit mit dem Erreger aufwies, den man als Auslöser der verheerenden Grippewelle von 1918 wähnte. Pandemieangst lag in der Luft. Die Presse rief den „monster killer“ aus. Und eine diffuse Angst fand nach den Fällen aus Philadelphia über Monate keine Erlösung, da es quälend lange nicht gelang, die Ursache für die rätselhafte Erkrankung der Legionäre zu enträtseln.2
Bob Dylan fasste 1978 dieses Unwohlsein mit seinem Songtext Legionnaire’s disease in Worte und überliefert uns darin eine Ahnung von den Gefühlen der Besorgnis, die damals um sich griffen. Er erinnert uns daran, dass wir niemals gefeit sein werden vor neuen Infektionserkrankungen und Infektionserkrankungen in neuem Gewand. Anders als befürchtet hatte die Legionärskrankheit nicht das Zeug zur Pandemie. In den 44 Jahren nach ihrer Erstbeschreibung mussten und müssen wir zwei andere infektiologische Großereignisse durchleben, eines verursacht durch HIV, ein weiteres durch SARS-CoV-2. Und wir hatten und haben neben vielen weiteren Problemen immer noch Ebola genauso wie multiresistente Erreger in unseren Krankenhäusern. Es war 1976, als die Gewissheit eines Sieges über die Infektionskrankheiten ins Wanken geriet.

Amerikanisches Heldenepos
Die Aufklärung der Infektionen von Philadelphia war – wie es in den USA nun mal so ist – ein Heldenepos, getrieben von der Brillanz und Hartnäckigkeit einzelner Wissenschaftler:innen (allen voran Joseph McDade, für seine Arbeit geehrt durch die Benennung von Legionella micdadei) sowie von Zufällen. Zufälle spielten in der Tat eine große Rolle. Mit konventionellen Methoden konnten keine Bakterien in den Lungen der Erkrankten und Verstorbenen gefunden werden und selbst als man Erreger mittels Elektronemikroskopie fand, glaubten viele, es handle sich um bakterielle Begleitinfektionen. Der Zufall wollte es, dass die Untersuchungen zu den Ereignissen in Philadelphia in Laboren durchgeführt wurden, wo Meerschweinchen (und nicht andere Labortiere) zum Nachweis von Rickettsien gehalten wurden.2 In diesen Tieren gelang es dem Team, in dem Joseph McDade arbeitete, schließlich den Erreger zu isolieren und ihn in befruchteten Eiern anzuzüchten. Die neue Spezies Legionella war damit identifiziert. Ihre Übertragungswege sollten im Verlauf der Zeit bekannt werden.
Epidemiologie
Fast 90 Legionellenspezies, davon 20 humanpathogene sind seit jenen Tagen beschrieben worden. L. pneumophila sei der wichtigste Vertreter, der die überwiegende Mehrheit der Erkrankungen beim Menschen verursache. So oder so ähnlich steht es geschrieben in vielen Publikationen zum Thema, oft gefolgt von der Einschränkung, dass diese Aussage möglicherweise nicht ganz der Wahrheit entspreche. Man weiß nämlich eigentlich zu wenig über die Häufigkeit von Legionellosen und die Speziesverteilung, weil fast überall auf der Welt die Diagnose der Legionärskrankheit auf dem Nachweis eines Antigens im Urin fußt durch einen Test, der nur L. pneumophila der Serogruppe 1 zuverlässig findet. Somit ist es wahrscheinlich, dass wir die wahre Bürde der Erkrankungen insgesamt, und besonders die, die auf das Konto anderer Spezies oder Serogruppen gehen, unterschätzen.
Weltweite Verbreitung
In Japan hat man genauer mittels Kultur nachgeschaut und gefunden, dass ca. 20% aller sporadischen Legionellenpneumonien von L. pneumophila Nicht-Serogruppe 1 oder von anderen Legionellenspezies verursacht werden.3 Auch in Australien und Neuseeland wird systematisch bei respiratorischen Proben mittels Kultur oder PCR nach Legionellen gesucht. Seit der flächendeckenden Einführung einer Legionellen-PCR in Neuseeland weiß man, dass dort L. longbeachae mit 63% der häufigste Erreger der Legionellenpneumonie ist.4 Diese Spezies wurde – ihr Name verrät es – erstmals in Kalifornien isoliert5, was ihr weltweites Vorkommen illustriert. Und dennoch scheint sie, abgesehen von einzelnen Ausbrüchen wie zum Beispiel in Schweden im Jahre 20186 jenseits von Australien und Neuseeland keine besonders große Rolle zu spielen.7
Europäische Daten
Wie sieht es bei uns aus? In einer paneuropäischen Studie, die nachgewiesene ambulant erworbene und nosokomiale Infektionen mit L. pneumophila in Serogruppen und Untergruppen aufgliederte waren in „Zentraleuropa“ – einer Region zu der auch Deutschland gehört – nur ca. 78% der Isolate Teil der Serogruppe 1.8 Und die anderen Spezies? Wir wissen es nicht so genau.
Die jährliche Legionelleninzidenzrate betrug 2010 in Neuseeland 5,4/ 100.000 Menschen. Bis dato die höchste Rate, die in der Literatur zu finden ist, vielleicht, weil man dort so intensiv testet. Für Deutschland berichtet die ECDC eine jährliche Inzidenzrate von 1,0/100.000 Menschen im Jahr 2015 die seitdem auf 1,9/ 100.000 im Jahr 2019 angestiegen ist. Modellierungen aus den Vereinigten Staaten suggerieren, dass wir die Zahl der Fälle um den Faktor 10 unterschätzen könnten.9
Deutschland
Gesetzliche
Wasserkontrollen
Die deutsche Trinkwasserverordnung schreibt in ihrer aktuellen Fassung (bekanntgemacht am 10. März 2016) eine regelmäßige Untersuchungspflicht auf Legionellen vor. Diese betrifft alle Inhaber von Trinkwasser-Installationen mit Großanlagen zur Trinkwassererwärmung, sofern aus diesen Trinkwasser im Rahmen einer gewerblichen und/oder öffentlichen Tätigkeit abgegeben wird und es zu einer Vernebelung des Trinkwassers (z.B. in Duschen) kommt. Diese Einrichtungen sind verpflichtet, einmal jährlich an mehreren repräsentativen Probennahmestellen auf Legionellen untersuchen zu lassen. Neu ist die erst seit Ende 2011 bestehende Untersuchungspflicht für weitere Gruppen, unter anderem für Besitzer/Vermieter von Mehrfamilienhäusern, Wohnungsbaugesellschaften und Hausverwaltungen. Für diese beträgt das geforderte Untersuchungsintervall drei Jahre.
In der Trinkwasserverordnung ist für Legionellen ein Technischer Maßnahmenwert von 100 koloniebildenden Einheiten (KBE) je 100 ml festgelegt. Wird bei einer Untersuchung eine Überschreitung dieses Wertes festgestellt, muss dies unmittelbar an das zuständige Gesundheitsamt gemeldet werden. Es kommt außerdem gemäß § 16 Abs. 7 TrinkwV zu weiteren Pflichten und technischen Maßnahmen wie einer Gefährdungsanalyse vor Ort bis hin zu einer ggf. erforderlichen umfassenden Sanierung der Trinkwasser-Installation.
In Deutschland wurden in einer der CAPNETZ-Studien bei 17% der Pneumonien mit Erregernachweis mittels Kultur und Urinantigentest Legionellen gefunden, das entsprach 3,4% aller Pneumonien (mit und ohne Erregernachweis).10 Die Beschränkung auf Antigentest und Kultur in diesem Datensatz lässt mit gutem Gewissen die Interpretation zu, dass die Bürde auch bei uns größer sein könnte.
Im Jahresverlauf kommt es zu einer Häufung von Fällen in den späten Sommer- und frühen Herbstmonaten. Infektionen mit L. longbeachae hingegen haben einen Inzidenzgipfel der in Richtung Frühjahr verschoben ist.
Medienhype Panik
Die Erkrankung ist trotzdem alles in allem nicht häufig, sie gewinnt aber zunehmend an Bedeutung und sie tritt abgesehen von sporadischen Fällen (die die Mehrheit der Erkrankungen ausmacht) im Rahmen von Ausbrüchen auf. Ausbrüche sind – nach dem Motto: panic sells – offensichtlich ein beliebtes Thema bei Editorinnen und Editoren von Fachzeitschriften. Wenn man bei Pubmed „Legionella“ und „Outbreak“ eintippt, findet man eine ganze Menge an Schilderungen von Ausbruchsgeschehen, bei deren Lektüre man fast den Eindruck bekommen könnte, dass die Menschheit unmittelbar vor der Vernichtung durch Legionellen steht, wenn sie nicht besser aufpasst und sofort alle Wasserheizungen und Leitungen erneuert. Und damit kommen wir zu den Übertragungswegen.
Transmission
Legionellen werden durch Aspiration von kontaminiertem Süßwasser und insbesondere durch Inhalation von kontaminiertem Wasserdampf übertragen. Sie vermehren sich in Wasserleitungen, Whirlpools, Spas, Kühlelementen von Klimaanlagen, Verneblern und Atembefeuchtungsapparaten, immer dann, wenn das Wasser nicht kalt oder heiß genug ist (d.h. ca. <20°C bzw. >50°C) und lange steht. Die Forschung zur Verhinderung und Elimination einer Legionellenbesiedelung von Wassersystemen in Gebäuden und Schiffen füllt – genau wie die Ausbruchsschilderungen – ein eigenes „Bücherregal“ bei PubMed, und das Krankenhauspersonal kennt nur zu gut die Situation, dass in der Klinik unangekündigt und über Nacht ein Wasserhahn abmontiert wurde, weil der Hygiene aufgefallen ist, dass dieser am Ende einer zu langen Einzelanbindung mit zu lange stehendem Wasser lag.
Gefahr aus der Dusche und dem Garten

L. longbeachae ist ein Ausreißer in dieser Geschichte, weil diese Spezies durch Inhalation von Staub kontaminierter Gartenerde und Kompost übertragen wird.11 Dieser Übertragungsweg macht den während der Pflanzperiode lokalisierten Inzidenzgipfel verständlich. Anders als in Europa enthält die in Australien und Neuseeland vertriebene Gartenerde häufig Pinienrinde und Sägespäne, Zutaten, die für gute Lebensbedingungen für L. longbeachae sorgen.7 Die Packung der in Berlin erworbenen Blumenerde enthält jedenfalls nicht wie in Neuseeland eine Empfehlung zum Tragen einer Maske.
Krankheitsbild
Legionellen sind für zwei Krankheitsbilder bekannt. Die Legionärskrankheit und das Pontiac Fieber. Die erste der beiden ist die gefährlichere Erkrankung. Nur sie ist Gegenstand dieses Artikels. Risikofaktoren sind Alter >50 Jahre, chronische Lungenerkrankung, Nikotingebrauch, Nierenerkrankungen, kardiovaskuläre Erkrankungen sowie Immundefizienz, wie sie bei hämatologischen und soliden Tumorerkrankungen unter Zytostatikatherapie, Haarzellleukämie, Glukokortikoidtherapie und Behandlung mit TNF-Alpha-Antagonisten auftreten kann. Das lässt die Frage aufkommen, ob HIV-Infizierte Patientinnen und Patienten häufiger von dieser Erkrankung betroffen sind oder mit einem schwereren Verlauf rechnen müssen. Diese Frage ist für uns hier bei HIV&more besonders wichtig, aber sie lässt sich aus der Literatur leider nicht klar beantworten. Immerhin liefert die Recherche bei PubMed beruhigende Signale, die kein überwältigendes Risiko für Menschen mit HIV-Infektion vermuten lassen.12
Einteilung
Ob
die häufig verwendete Einteilung in ambulant erworben,
reiseassoziiert und nosokomial klinisch sinnvoll ist, bleibt
dahingestellt. Sinnvoll ist unzweifelhaft, bei jedem einzelnen Fall
danach Ausschau zu halten, ob das
Individuum Teil eines
Clusters oder Ausbruchs sein könnte. Aber auch wenn Ausbrüche immer
wieder für spektakuläre Publikationen gut sind, so sind die meisten
Fälle doch sporadische, ambulant erworbene Erkrankungen.
Klinik
Die Legionärskrankheit ist fast immer eine pulmonale Erkrankung im Sinne einer ambulant erworbenen oder nosokomialen Pneumonie – unabhängig von der verursachenden Spezies oder Serogruppe. Die Inkubationszeit beträgt zwei bis 14 Tage.13 Klinische Symptome und Zeichen sind – wie bei anderen „klassischen“ Erregern – Husten, Atemnot und Fieber. Patientinnen und Patienten mit Legionärskrankheit produzieren nicht regelhaft verwertbares Sputum, und wenn sie das tun, ist die Zahl der neutrophilen Granulozyten im Auswurf gering, was einige Labore dazu bewegt, die Proben zu verwerfen. Beides beeinflusst die Effizienz der Diagnostik.
Differentialdiagnose
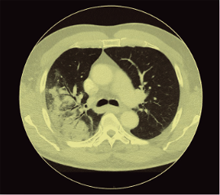
CT-Thorax eines HIV-infizierten Patienten mit Legionellenpneumonie© SJK
Radiologisch finden sich keine Befunde, die eine sichere Unterscheidung von Legionellen von anderen Pneumonieerregern erlauben würden. Die pulmonalen Infiltrate weisen keine Spezifika auf, die sie von einer Pneumokokken-Pneumonie unterscheidbar machen würden. Sie betreffen meist einen der Unterlappen. Einschmelzungen und größere Pleuraergüsse sind selten. Im Verlauf der Erkrankung kann sich das radiologische Bild trotz klinischer Besserung verschlechtern, was die Behandelnden nicht irritieren sollte.14, 15
Das Routinelabor hilft in Sachen Differentialdiagnostik leider ebenso wenig wie die Bildgebung weiter: Das CrP ist erhöht, man findet relativ häufig eine Hyponatriämie, aber das findet man auch mal bei Patienten ohne Legionärskrankheit.
Die Mortalität einer Legionellose liegt zwischen ein und zehn Prozent.16
Prädiktion
Es gab Versuche, die Diagnose einer Legionärskrankheit vorherzusagen.17 Keiner davon erwies sich als ausreichend spezifisch, was aus dem oben Gesagten schon abzuleiten ist. Und dennoch gibt es vier „Rote Fahnen“18, die uns besonders intensiv an eine Legionellose denken lassen sollten:
- kürzliche Reise
- Hyponatriämie
- Diarrhoe
- Fieber über 38°C
Weil es kein 100% zuverlässiges Instrument zur Unterscheidung einer Legionellen-Pneumonie von anderen Lungenentzündungen gibt, muss bei allen Menschen mit einer CAP auch in Abwesenheit der „roten Fahnen“ diese Differentialdiagnose berücksichtigt und deren Wahrscheinlichkeit abgewogen werden.
Diagnostik
Der Legionellen-Antigenschnelltest im Urin ist das Arbeitspferd der Legionellen-Diagnostik. Dieses Pferd hat allerdings seine Macken. Es detektiert – wie schon weiter oben ausgeführt – nur L. pneumophila der Serogruppe 1, eine Spezies, die in Deutschland möglicherweise weniger als 80% der Erkrankungen verursacht. Die Sensitivität des Tests ist für L. pneumophila der Serogruppe 1 hoch, besonders bei schwer erkrankten Menschen, die schon ein paar Tage symptomatisch sind.19
Insgesamt scheint bei Patientinnen und Patienten mit leichter Pneumonie der negative Vorhersagewert im Falle eines negativen Testergebnisses auszureichen, um die Diagnose einer Legionellose unwahrscheinlich zu machen. Das liegt daran, dass der Anteil der Legionellen-Pneumonien in dieser Gruppe gering ist, und selbst wenn eine leichte Pneumonie tatsächlich durch Legionellen verursacht wird, scheint ein guter Teil der betroffenen Menschen auch ohne spezifische Therapie wieder gesund zu werden.
Diese Überlegungen spiegeln sich in der Deutschen CAP Leitlinie wieder, die bei der leichten Pneumonie keine Legionellen-aktive Therapie und bei der mittelschweren Pneumonie eine solche Therapie nur als optional empfiehlt.16 Anders sieht es aus bei Menschen mit schwerer CAP, bei denen die Prävalenz und die Prätestwahrscheinlichkeit einer Legionellose höher ist, und damit der negativ prädiktive Wert des Antigentests sinkt. Bei diesem Kollektiv – insbesondere im Falle eines Versagens einer Betalaktam-Monotherapie – darf ein negativer Test nicht als sicherer Ausschluss einer Legionellose gewertet werden, was Folgen für die weitere Diagnostik und Therapie nach sich zieht. Viele Leitlinien berücksichtigen diese Überlegung. Sie empfehlen bei negativem Antigentest eine Initiierung bzw. Fortsetzung einer Legionellen-wirksamen Therapie und eine zusätzliche PCR- bzw. kulturelle Diagnostik, wenn eine klinische Stabilisierung ausbleibt.
Urintest

SARS-CoV-2 Schnelltest des Autors. Ein Testprinzip, das wir fast ausschließlich für den Nachweis des Legionellenantigens im Urin verwenden© Photo Hartmut Stocker
Die Spezifität des Urinantigentests für L. pneumophila SG 1 ist hoch, aber nicht 100% weil der Test bis zu 300 Tage nach durchgemachter Legionärskrankheit noch positiv sein kann.19
Wenn also der Urinantigentest negativ ist und die Pneumonie schwer verläuft und/oder nicht auf eine Betalaktam-Monotherapie anspricht, sollte eine PCR auf Legionellen aus Atemwegssekreten veranlasst und eine Legionellen-wirksame Therapie initiiert bzw. fortgesetzt werden.16 Eine Untersuchung von respiratorischen Proben mittels PCR kann Legionellen aller Spezies und Serogruppen nachweisen und kompensiert damit die offene Flanke des Urinantigentests.
Kulturelle Nachweisverfahren sind in Deutschland nur in wenigen Laboren etabliert. Sie haben zudem Schwachstellen in der Präanalytik, weil die Transportzeiten für das Überleben der Bakterien entscheidend sind.
Therapie
Aus einer klinisch pragmatischen Perspektive stellt sich bei jedem Patienten mit Pneumonie – sei es in der Notaufnahme oder in der Praxis – als Erstes die Frage, ob eine Legionellen-wirksame Therapie bei diesem Individuum das Behandlungsergebnis verbessern könnte. Und damit sind wir bei der Abwägung zwischen Individualmedizin und Medizin für die Gruppe. Der Einsatz von Antiinfektiva fügt der Gruppe – im Falle eines inadäquaten Einsatzes – Schaden zu und sie hilft – im Falle eines adäquaten Einsatzes – einzelnen Individuen. Wenn wir gesondert die Population der Menschen mit leichter Pneumonie betrachten, orientieren uns zwei Studien bei dieser Abwägung: Eine Metaanalyse von Kohortenstudien20 und eine cluster-randomisierte Studie.21
Legionellen-Antibiose bei CAP?
Die Metaanalyse kommt zum Ergebnis, dass eine Legionellen-wirksame Therapie das Behandlungsergebnis insgesamt nicht signifikant verbessert. Eine ca. 1% kleine Subpopulation von Menschen, die tatsächlich eine nachgewiesene Legionellose hatte, profitierte allerdings von einer solchen Behandlung. Die prospektive, cluster-randomisierte Studie, die in den Niederlanden bei 2.283 stationär aufgenommenen Patientinnen und Patienten mit CAP durchgeführt wurde, verglich in Bezug auf die 90 Tage (all cause) Mortalität drei Therapiestrategien: Betalaktam-Monotherapie versus Betalaktam plus Makrolid versus Fluorchinolon-Monotherapie. Überraschenderweise war die Betalaktam-Monotherapie (bei einer Nichtunterlegenheitsgrenze von 3% und einem zweiseitigen CI von 90%) im Vergleich sowohl zur Betalaktam-Makrolid-Kombination als auch zur Fluorchinolon-Monotherapie nicht-unterlegen. Zum Zeitpunkt des Studieneinschlusses wurde die Mortalität der Patient:innen gemäß des Pneumonia Severity- (ca. 85 Punkte) und des CURB-65-Index’ (einen Punkt) als niedrig eingestuft, und der Anteil der Patient:innen mit nachgewiesener Legionärskrankheit belief sich auf unter 1%. Bemerkenswert war in dieser Studie, dass die Kombinationstherapie mit Makroliden das Behandlungsergebnis im Vergleich zur Betalaktam-Monotherapie tendenziell verschlechterte, was ein Hinweis darauf sein könnte, dass durch unerwünschte Arzneimittelwirkungen der Makrolide (insbesondere durch deren Kardiotoxizität) der Gesamtgruppe mehr Schaden zugefügt wurde, als dass deren Einsatz einzelnen Individuen half, ihre Pneumonie zu überstehen. Diese und andere Studien begründen, warum die deutsche CAP Leitlinie bei Menschen mit nicht-schwerer Pneumonie kein Legionellen-aktives Antiinfektivum empfiehlt.16
Schwere Pneumonie
Bei den Empfehlungen zur Therapie der nicht-leichten Pneumonie spielen zwei Überlegungen eine Rolle: i) Der Einsatz von Makroliden kann möglicherweise durch eine nicht-antibiotische, antiinflammatorische Wirkung auch bei Patientinnen und Patienten ohne Legionellen das Behandlungsergebnis verbessern und ii) die Häufigkeit von Legionellen-Erkrankungen ist in dieser Gruppe höher als in der Gruppe mit nicht-schwerer Pneumonie. Eine Analyse aus dem Schatz der CAPNETZ-Studien zeigt auf, dass sich die Schere in Bezug auf die Sterblichkeit von Patientinnen und Patienten mit Pneumonie ab einem CRB-65 Wert von >1 durch eine Kombinationstherapie mit „atypical coverage“ öffnet und dass eine Kombination aus Betalaktam plus Makrolid hier das Behandlungsergebnis verbessern könnte.22 Auf der Basis dieser Datenlage, empfiehlt die deutsche CAP Leitlinie bei schwerer Pneumonie eine Kombinationstherapie aus Betalaktam und Legionellen-aktiver/antiinflammatorischer Therapie mit einem Makrolid. Bei mittelschwerer Pneumonie empfiehlt sie, diese Kombination nach individueller Abwägung zum Einsatz zu bringen.16
Nachgewiesene Legionellen-Infektion
Meldepflicht
In Deutschland ist der direkte oder indirekte Nachweis von Legionellen (Legionella sp) namentlich meldepflichtig nach
§
7 des Infektionsschutzgesetzes,
soweit der Nachweis
auf eine akute Infektion hinweist.
Makrolide, Ketolide, Fluorchinolone und Tetracykline besitzen anders als Betalaktam-Antibiotika Aktivität gegen die intrazellulär lokalisierten Legionellen. Heraus kam dies durch einen dieser zuvor erwähnten glücklichen Zufälle: Die Behandlungsergebnisse der Legionäre in Philadelphia waren in Kliniken der Maximalversorgung – wo all die neuen Betalaktam-Antibiotika eingesetzt wurden – schlechter als in kleineren Häusern, wo man noch auf aus der Zeit gefallene Antibiotika wie Erythromycin vertraute.2 Wenn man davon ausgeht, dass die erkrankten Legionäre nach dem Zufallsprinzip auf die Krankenhäuser verteilt wurden, handelt es sich dabei um die einzige randomisierte – wenn auch nicht kontrollierte – Studie, die je die Fragestellung nach der besten gezielten Therapie adressiert hat. Richtige randomisierte Studien, die unterschiedliche Substanzklassen, einzelne Substanzen innerhalb der Klassen oder Kombinationstherapien vergleichen, fehlen bis heute. Lediglich Kohortenstudien und Metaanalysen dieser Studien legen nahe, dass Makrolide und Levofloxacin, jeweils als Monotherapie, die besten Therapieoptionen sein könnten.
Makrolide
Unter den Makroliden wird Azithromycin in einigen Leitlinien bevorzugt, weil diese Substanz im Gegensatz zu Clarithromycin im Labor bakterizid gegen Legionellen wirkt und weil sie als am wenigsten kardiotoxisch innerhalb der Klasse gilt. Demgegenüber steht der immer deutlicher werdende, lang anhaltende Resistenz-treibende Effekt von Azithromycin auf das (orale) Mikrobiom, insbesondere auf orale Streptokokken.23,24 So sieht der Autor dieser Zeilen keinen Grund für eine eindeutige Empfehlung für das eine oder das andere Makrolid.
Flourchinolone
Innerhalb
der Klasse der Fluorchinolone wird in fast allen internationalen
Leitlinien Levofloxacin bevorzugt, weil es zu dieser Substanz die
meisten Daten aus Kohortenstudien gibt, auch wenn theoretische
Überlegungen für Moxifloxacin bessere Behandlungsergebnisse in
Aussicht stellen. Theoretische Überlegungen, die deutsche
Pulmonologen und damit auch die Leitlinienkommission zu Moxifloxacin
tendieren ließ, obwohl auch für diese Empfehlung keinerlei solide
klinische Daten vorhanden sind. Wie Azithromycin ist Moxifloxacin
wegen seines negativen Einflusses auf das Mikrobiom von der
ABS-Community als „Antichrist“ verpönt, was (auch für den Autor
dieser Zeilen) als Argument gegen seinen routinemäßigen Einsatz
großes Gewicht besitzt. Lassen Sie uns deshalb bei Levofloxacin
bleiben:
Levofloxacin ist in Studien zur nachgewiesenen
Legionellose das am häufigste eingesetzte Fluorchinolon dessen Dosis
nicht 1x 500 mg/d sondern 1x 750 mg/d betragen sollte.
Kombination?
Es gibt keine Signale in der Literatur, die dafür sprechen, eine Legionellen-Pneumonie mit einer Kombination aus Makrolid und Flourchinolon bzw. einer Kombination aus einem der beiden mit Rifampicin zu behandeln. Welche Rolle Doxycyclin spielt, ist leider auch ungeklärt. Fest steht lediglich, dass L. longbeachae häufig resistent gegen Tetrazykline ist25, was für Deutschland allerdings wegen des angenommen seltenen Vorkommens dieser Spezies und des seltenen Einsatzes von Tetrazyklinen bei der Behandlung der CAP keine große Relevanz besitzt.
Therapiedauer
Auch
zur Dauer der Therapie gibt es keine soliden Daten. Die deutsche
CAP-Leitlinie empfiehlt eine Therapiedauer je nach klinischem Verlauf
von fünf bis zehn Tagen und sieht keine Evidenz für eine Ausweitung
der
Behandlungsdauer über 14 Tage.16
Zusammenfassung
Die Legionärskrankheit fesselt uns seit mehr als vierzig Jahren. Sie verdankt ihre Faszination der Tatsache, dass sie uns spektakuläre Ausbrüche beschert und eine relativ hohe Letalität aufweist. Wir wissen immer noch nicht genau, wie viele Lungenentzündungen auf ihr Konto gehen. Es dürften in Deutschland unter den schwer kranken Menschen aber deutlich mehr als vier Prozent sein und die Inzidenz scheint langsam, aber kontinuierlich zu steigen. Rechnen Sie besonders in den warmen Monaten mit der Legionärskrankheit. Sporadische Fälle sind weit häufiger als reiseassoziierte und nosokomial erworbene Fälle. Selten kommt es zu Ausbruchsgeschehen, die beispielsweise von Klimaanlagen, Badeanstalten oder den Wasserleitungssystemen von großen Gebäuden ausgehen. Ausbrüche können auch auf Kompost und Gartenerde zurückgeführt werden. L. lonbeachae ist die Spezies nach der diesbezüglich mittels PCR (oder Kultur) Ausschau gehalten werden muss.
Unsere
Diagnostik, die auf dem Antigennachweis im Urin fußt, ist die
Achillesferse unserer Teststrategie, weil wir mit dieser Untersuchung
vermutlich nur weniger als 80% der Legionellosen nachweisen können.
Bei Menschen mit leichter Pneumonie ist diese Schwachstelle (wegen
der niedrigen Prävalenz und Mortalität in
dieser Gruppe) kein
Problem. Bei Menschen mit Nicht-leichter Pneumonie muss allerdings
dieses Manko der Diagnostik berücksichtigt werden: Durch ergänzende
(PCR-, oder kulturelle) Diagnostik und durch Initiierung bzw.
Fortsetzung einer Legionellen-wirksamen Therapie. Im Klartext heißt
dies, dass die überwiegende Mehrheit der Menschen mit einer leichten
Pneumonie nicht von einer Legionellen-wirksamen Therapie profitiert.
Im
Gegensatz dazu sollten Menschen mit schwerer Pneumonie
kalkuliert immer eine Legionellen-wirksame Behandlung erhalten bzw.
sollte eine solche Therapie bei fehlender klinischer Besserung unter
Betalaktam-Monotherapie initiiert werden. Bei Patientinnen und
Patienten mit mittelschwerer Pneumonie kann es vertretbar sein, die
„atypical coverage“ wegzulassen oder sehr rasch zu beenden.
Die optimale Therapie der nachgewiesenen Legionärskrankheit ist nicht durch prospektive, randomisierte Studien definiert. Fluorchinolone, allen voran Levofloxacin in hoher Dosierung sowie Makrolide werden in nationalen und internationalen Leitlinien als bevorzugte Substanzen genannt. Doxycyclin ist die Alternative mit der geringsten Evidenzbasis. Ein weiterer Malus für Doxycyclin ist, dass L. longbeachae Resistenzen gegen dieses Antibiotikum aufweist.
Kombinationstherapien sind auch nicht prospektiv untersucht. Sie weisen gemäß den bisher durchgeführten Kohortenanalysen keinen Behandlungsvorteil gegenüber den Monotherapien auf.
Wie vieles andere ist auch die Behandlungsdauer nicht systematisch untersucht. Die Deutsche CAP Leitlinie kommt auf dem Boden der spärlichen Evidenz zur Schlussfolgerung, dass die Therapiedauer je nach klinischem Verlauf fünf bis zehn Tage betragen sollte.
1 Fraser DW, Tsai TR, Orenstein W, Parkin WE, Beecham HJ, Sharrar RG, Harris J, Mallison GF, Martin SM, McDade JE et al: Legionnaires‘ disease: description of an epidemic of pneumonia. The New England journal of medicine 1977, 297(22):1189-1197, DOI: 10.1056/nejm197712012972201.
2 Winn WC, Jr.: Legionnaires disease: historical perspective. Clinical microbiology reviews 1988, 1(1):60-81, DOI: 10.1128/cmr.1.1.60.
3 Miyashita N, Higa F, Aoki Y, Kikuchi T, Seki M, Tateda K, Maki N, Uchino K, Ogasawara K, Kiyota H et al: Distribution of Legionella species and serogroups in patients with culture-confirmed Legionella pneumonia. Journal of infection and chemotherapy : official journal of the Japan Society of Chemotherapy 2020, 26(5):411-417, DOI: 10.1016/j.jiac.2019.12.016.
4 Priest PC, Slow S, Chambers ST, Cameron CM, Balm MN, Beale MW, Blackmore TK, Burns AD, Drinković D, Elvy JA et al: The burden of Legionnaires‘ disease in New Zealand (LegiNZ): a national surveillance study. The Lancet Infectious diseases 2019, 19(7):770-777, DOI: 10.1016/s1473-3099(19)30113-6.
5 McKinney RM, Porschen RK, Edelstein PH, Bissett ML, Harris PP, Bondell SP, Steigerwalt AG, Weaver RE, Ein ME, Lindquist DS et al: Legionella longbeachae species nova, another etiologic agent of human pneumonia. Annals of internal medicine 1981, 94(6):739-743, DOI: 10.7326/0003-4819-94-6-739.
6 Löf E, Chereau F, Jureen P, Andersson S, Rizzardi K, Edquist P, Kühlmann-Berenzon S, Galanis I, Schönning C, Kais M et al: An outbreak investigation of Legionella non-pneumophila Legionnaires‘ disease in Sweden, April to August 2018: Gardening and use of commercial bagged soil associated with infections. Euro surveillance : bulletin Europeen sur les maladies transmissibles = European communicable disease bulletin 2021, 26(7), DOI: 10.2807/1560-7917.es.2021.26.7.1900702.
7 Chambers ST, Slow S, Scott-Thomas A, Murdoch DR: Legionellosis Caused by Non-Legionella pneumophila Species, with a Focus on Legionella longbeachae. Microorganisms 2021, 9(2), DOI: 10.3390/microorganisms9020291.
8 Helbig JH, Bernander S, Castellani Pastoris M, Etienne J, Gaia V, Lauwers S, Lindsay D, Lück PC, Marques T, Mentula S et al: Pan-European study on culture-proven Legionnaires‘ disease: distribution of Legionella pneumophila serogroups and monoclonal subgroups. European journal of clinical microbiology & infectious diseases : official pub-lication of the European Society of Clinical Microbiology 2002, 21(10):710-716, DOI: 10.1007/s10096-002-0820-3.
9 Cassell K, Gacek P, Rabatsky-Ehr T, Petit S, Cartter M, Weinberger DM: Estimating the True Burden of Legionnaires‘ Disease. American journal of epidemiology 2019, 188(9):1686-1694, DOI: 10.1093/aje/kwz142.
10 Kothe H, Bauer T, Marre R, Suttorp N, Welte T, Dalhoff K: Outcome of community-acquired pneumonia: influence of age, residence status and antimicrobial treatment. The European respiratory journal 2008, 32(1):139-146, DOI: 10.1183/09031936.00092507.
11 Steele TW, Lanser J, Sangster N: Isolation of Legionella longbeachae serogroup 1 from potting mixes. Applied and environmental microbiology 1990, 56(1):49-53, DOI: 10.1128/aem.56.1.49-53.1990.
12 Cillóniz C, Miguel-Escuder L, Pedro-Bonet ML, Falcó V, Lopez Y, García-Vidal C, Gabarrús A, Moreno A, Torres A, Miró JM: Community-Acquired Legionella Pneumonia in Human Immunodeficiency Virus-Infected Adult Patients: A Matched Case-Control Study. Clin Infect Dis 2018, 67(6):958-961, DOI: 10.1093/cid/ciy314.
13 Cunha BA, Burillo A, Bouza E: Legionnaires‘ disease. Lancet (London, England) 2016, 387(10016):376-385, DOI: 10.1016/s0140-6736(15)60078-2.
14 Mittal S, Singh AP, Gold M, Leung AN, Haramati LB, Katz DS: Thoracic Imaging Features of Legionnaire‘s Disease. Infectious disease clinics of North America 2017, 31(1):43-54, DOI: 10.1016/j.idc.2016.10.004.
15 Poirier R, Rodrigue J, Villeneuve J, Lacasse Y: Early Radiographic and Tomographic Manifestations of Legionnaires‘ Disease. Canadian Association of Radiologists journal = Journal l‘Association canadienne des radiologistes 2017, 68(3):328-333, DOI: 10.1016/j.carj.2016.10.005.
16 Ewig S, Kolditz M, Pletz M, Altiner A, Albrich W, Droe-mann D, Flick H, Gatermann S, Krüger S, Nehls W et al: Behandlung von erwachsenen Patienten mit ambulant er- worbener Pneumonie-Update 2021. In: AWMF online.2021.
17 Cunha BA: Clinical features of legionnaires‘ disease. Seminars in respiratory infections 1998, 13(2):116-127, DOI:
18 Bellew S, Grijalva CG, Williams DJ, Anderson EJ, Wunderink RG, Zhu Y, Waterer GW, Bramley AM, Jain S, Edwards KM et al: Pneumococcal and Legionella Urinary Antigen Tests in Community-acquired Pneumonia: Prospective Evaluation of Indications for Testing. Clin Infect Dis 2019, 68(12):2026-2033, DOI: 10.1093/cid/ciy826.
19 Kohler RB, Winn WC, Jr., Wheat LJ: Onset and duration of urinary antigen excretion in Legionnaires disease. Journal of clinical microbiology 1984, 20(4):605-607, DOI: 10.1128/jcm.20.4.605-607.1984.
20 Mills GD, Oehley MR, Arrol B: Effectiveness of beta lactam antibiotics compared with antibiotics active against atypical pathogens in non-severe community acquired pneumonia: meta-analysis. BMJ 2005, 330(7489):456, DOI: 10.1136/bmj.38334.591586.82.
21 Postma DF, van Werkhoven CH, van Elden LJ, Thijsen SF, Hoepelman AI, Kluytmans JA, Boersma WG, Compaijen CJ, van der Wall E, Prins JM et al: Antibiotic treatment strategies for community-acquired pneumonia in adults. The New England journal of medicine 2015, 372(14):1312-1323, DOI: 10.1056/NEJMoa1406330.
22 Tessmer A, Welte T, Martus P, Schnoor M, Marre R, Suttorp N: Impact of intravenous {beta}-lactam/macrolide versus {beta}-lactam monotherapy on mortality in hospitalized patients with community-acquired pneumonia. The Journal of antimicrobial chemotherapy 2009, 63(5):1025-1033, DOI: 10.1093/jac/dkp088.
23 Kastner U, Guggenbichler JP: Influence of macrolide antibiotics on promotion of resistance in the oral flora of children. Infection 2001, 29(5):251-256, DOI: 10.1007/s15010-001-1072-3.
24 Davidson RJ: In vitro activity and pharmacodynamic/pharmacokinetic parameters of clarithromycin and azithromycin: why they matter in the treatment of respiratory tract infections. Infection and drug resistance 2019, 12:585-596, DOI: 10.2147/idr.s187226.
25 Forsberg KJ, Patel S, Wencewicz TA, Dantas G: The Tetracycline Destructases: A Novel Family of Tetracycline-Inactivating Enzymes. Chemistry & biology 2015, 22(7):888-897, DOI: 10.1016/j.chembiol.2015.05.017.
Infektoskop – ein Streifzug durch die Infektiologie
Hier kann sogar der erfahrene Infektiologe dazu lernen. Spannende Kasuistiken kurzweilig erzählt zum Nachdenken und Nachlesen. https://www.sjk.de/kliniken/klinik-infektiologie/infektoskop-ein-streifzug-durch-die-infektiologie.html












 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
