International Liver Congress 22.-26. Juni 2022, London
 Auf der Zielgeraden – Neue Therapien bei Hepatitis B und D
Auf der Zielgeraden – Neue Therapien bei Hepatitis B und D
Die Jahrestagung der EASL fand in London statt. 5.500 Teilnehmer*innen waren nach London angereist – trotz der logistischen Schwierigkeiten aufgrund von Flughafenüberlastungen und Streik im Londoner Nahverkehr. 1.500 Interessierte genossen den Kongress auf der gut funktionierenden Plattform zuhause am Computer. Die Themen waren breit gestreut, die viralen Hepatitiden ein Thema unter vielen.

Hepatitis C
Bei der Hepatitis C gab es das schon mittlerweile übliche Update zum Fortschritt der Hepatitis C-Elimination und die üblichen Berechnungen, dass es zu langsam voran geht, begleitet von den entsprechenden Appellen. Reinfektionen scheinen – zumindest in den Industrieländern mit gutem Zugang zur Therapie – selten zu sein und vor allem bei MSM vorzukommen. So wurden in Wien zwischen 2007 und 2020 134 Fälle einer akuten Hepatitis B bei 119 Personen beobachtet. Dabei fand sich nach der breiten Verfügbarkeit von DAA im Jahr 2018 ein Anstieg der Häufigkeit. Betroffene waren vor allem Männer (92%), meist MSM (85%) und HIV-positiv (88%). Die jährliche Inzidenz stieg von 7,6 auf 17,11 in der DAA-Ära. Bei den IV-Drogengebrauchern war ein Anstieg von Reinfektionen dagegen nicht zu verzeichnen (Chromy D et al., FRI328).
Akute Hepatitis C
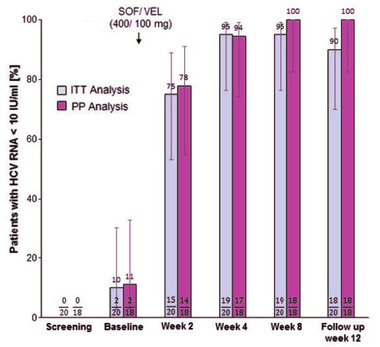
Abb. 1 Sofosbuvir/Velpatasvir bei akuter Hepatitis C
Zur Behandlung der akuten Hepatitis C reichen acht Wochen Glecaprevir/Piprentasvir (G/P) oder wie eine deutsche Arbeit belegt auch acht Wochen Velpatasvir/Sofosbuvir (VEL/SOF) (Massoumy et al., FRI 385) (Abb. 1). VEL/SOF ist allerdings nicht für eine achtwöchige Therapie und beide Medikamente sind nicht zur Therapie der akuten Hepatitis C zugelassen. Die im letzten Jahr erschienenen Leitlinien der DGVS sprechen allerdings bereits von einer Chronifizierung, wenn die HCV-RNA nach 4 Wochen nicht mindestens um 2 log-Stufen abgefallen ist bzw. nach 12 Wochen noch nachweisbar ist.
Re-Therapie nach DAA-Versagen
Nach Versagen einer NS5A-haltigen DAA-Therapie der Hepatitis C ist eine erneute Behandlung mit VOX/VEL/SOF (Vosevi®) oder G/P (Maviret®) plus Sofosbuvir (Solvadi®) mit/ohne Ribavirin aussichtsreich. In der europäischen Datensammlung (n=458) erreichten 94% nach 12 Wochen VOX/VEL/SOF die SVR, wobei Personen ohne VEL/SOF-Vorbehandlung besser abschnitten (95% vs 87%). Negative Prädiktoren waren Leberzirrhose und HCC (Graf C et al., OS003). In der australischen Beobachtung (n=66) erreichten 98% nach G/P plus SOF über 16 Wochen. Die Zugabe von Ribavirin hatte keinen zusätzlichen Effekt. Gründe für Therapieversagen waren in erster Linie „nicht virologisch“, vermutlich Adhärenz-Probleme. Drei Viertel der „Versager“ waren aktive Drogengebraucher (Gane E et al., OS004).
DAA und Antiepileptika
Während einer DAA-Therapie nehmen rund ein Viertel der Behandelten ein Medikament, 9% sogar zwei und mehr Medikamente mit potentiellen Interaktionen. Als problematisch galt bisher vor allem die Kombination mit Antiepileptika. Hier wurde die Ampel in der Liverpool „HEP interaction checker database“ aufgrund von neuen Daten von „rot“ auf „gelb“ gestellt, d.h. einer Kombination steht bei entsprechender Überwachung nichts mehr entgegen (Tacke F et al., FRI393, Burger D et al., FRI383).
DAA in Schwangerschaft?
Die Diagnose einer Hepatitis C wird in den USA (insbesondere bei Drogengebraucherinnen) nicht selten im Rahmen einer Schwangerschaft gestellt. Diese Patientinnen gleich zu behandeln, erscheint aussichtsreich. In einer Pilotstudie konnten von 23 Frauen, die einer Therapie zustimmten, sieben während der Schwangerschaft und acht postpartal behandelt werden. 12/15 beendeten die Therapie, 7/15 erschienen zu SVR12 und 6/7 erreichten die SVR. Laut den Autoren deuten „emerging data“ darauf hin, dass DAA während der Schwangerschaft sicher sind. Ein DAA-Schwangerschaftsregister ist in Planung (Gupta et al., FRI418).
Hepatitis B
Bei der Hepatitis B sind viele Substanzen in der Pipeline, ein Durchbruch ist nicht in Sicht, doch immerhin einige vielversprechende Substanzen mit dem Ziel der funktionellen Heilung. Die beiden Substanzen von J&J, ein siRNA und ein CAM-Inhibitor wurden allein und in Kombination in den Studien REEF-1 und -2 geprüft. In REEF-2 kam es unter der Kombination zwar nicht zum Verlust von HBsAg, aber zu einem deutlichen Abfall des HBsAg-Spiegels.
Cave NUKE-Stopp
In REEF-2 war – wie bei vielen anderen Studien auch – ein Stopp einer länger laufenden NUKE-Therapie vorgesehen. Bei einem Patienten, einem 54jährigen Mann in der Placebo-Gruppe, war es nach Absetzen von Tenofovir zu so einem heftigen Flare gekommen, dass eine Lebertransplantation nötig wurde (Agarwal K et al., GS010). Dieser Fall zeige, so betonten viele Hepatologen, dass man bei Absetzen von NUKEs vorsichtig sein sollte und engmaschige Kontrollen obligat sind.
Bepirovirsen im Aufwind
Besonders potent scheint Bepirovirsen zu sein, ein Antisens Oligonukleotid (ASO; früher GSK-3228836), das wöchentlich subkutan gespritzt wird. In der Phase-2b-Studie erhielten unbehandelte bzw. unter einem Nukleosid supprimierte Patienten Bepirovirsen. Nach 24 Wochen war bei rund einem Drittel der Patienten HBsAg und HBV-DNA nicht mehr nachweisbar im Vergleich zu weniger als 10% Patienten in den anderen Studienarmen (Abb. 2). Die Verträglichkeit war gut, am häufigsten waren lokale Injektionsreaktionen. Eine Phase-3- Studie mit Bepirovirsen allein sowie in Kombination mit Interferon soll Ende des Jahres starten (Yuen MF et al., LB004A).
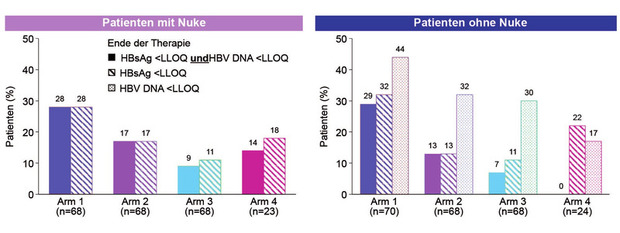
Abb. 2 B-Clear: Bepirovirsen bei chronischer Hepatitis B mit/ohne Nuke. Primärer Endpunkt zu Woche 24
Am Start ist auch ATI-2173, ein Pro-Drug des NRTI Clevudin, dessen Entwicklung wegen Muskelproblemen gestoppt wurde. Die neue Variante scheint Leber-spezifischer und damit auch besser verträglich zu sein. In der kleinen Studie SAVE-1 erhielten therapienaive Patienten 12 Wochen lang ATI-2173 plus TDF bzw. TDF allein. Nach Absetzen der Behandlung blieb die Viruslast nach der dualen Therapie länger supprimiert und es gab keine Flares (Tomas M et al., OS095).
PegIFN – Switch oder Add-on?
Pegyliertes Interferon allein oder in Kombination mit einem Nuke wurde ja schon mehrfach untersucht, jedoch noch nie in einer so großen kontrollierten Studie. In der chinesischen Studie EVEREST Real-Life-Project wurden 4.000 supprimierten HBeAg-negative Nuke-behandelte Patienten (HBsAG <1.500 IU/ml) entweder auf pegIFN umgestellt oder erhielten das Interferon als Add on. Nach 48 Wochen hatten 33% in der Kombinationsgruppe HBsAg verloren (Abb. 3). Prädiktoren waren ein niedriges HBsAg bei Baseline, ein Abfall zu Woche 24 und ein Anstieg der GPT Woche 24. Die Verträglichkeit des pegylierten Interferon war gut, schwere Nebenwirkungen wurden nicht beobachtet ( Xie C et al., SAT369).
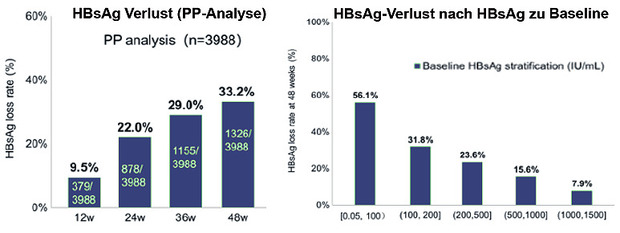
Abb. 3 EVERST: PegIFN add on oder Switch bei supprimierter HBeAg-negativer Hepatitis B. HBsAg-Verlust zu Woche 48
Hepatitis D
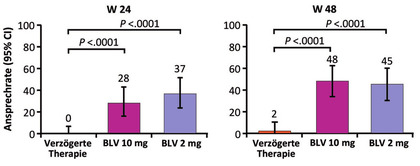
Abb. 4 Bulevirtid Monotherapie bei chronischer Hepatitis D. Primärer Endpunkt nach 24 und 48 Wochen
Bulevirtid (Hepcludex®) ist mittlerweile seit Mitte 2020 zugelassen. Diese Zulassung basiert auf Daten von Phase-2-Studien. Nun wurde das Ergebnis der Phase-3-Studie vorgestellt, das im wesentlichen die bekannten Daten bestätigt. Unter der (zugelassenen) Dosierung von 2 mg Monotherapie wöchentlich subkutan erreichten 45% den primären Endpunkt (Abfall HDV-RNA >2log und GPT-Normalisierung) sowie 71% einen Abfall der HDV-RNA um >2log sowie 20% eine nicht nachweisbare HDV-RNA und 51% eine GPT-Normalisierung (Abb. 4). HBsAg blieb unbeeinflusst. Die höhere Dosierung von 10 mg war nicht wesentlich effektiver und der Effekt der Therapie auf „Patient Reported Outcomes“ war unter der niedrigeren Dosierung günstiger (Wedemeyer H et al., GS006).
In der kleinen Pilotstudie wurde Bulevirtid auch bei Patienten mit Zirrhose und portaler Hypertension eingesetzt. Auch hier kam es bei der Mehrzahl der Patienten zum Abfall der HDV-Viruslast um mehr als 2log (78%) und zur GPT-Normalisierung (83%). Der signifikante Anstieg der Gallensäuren war klinisch nicht relevant (Depasperi E et al., SAT249).
Real World
Nachdem die Substanz schon länger zur Verfügung steht, gab es auch Daten „aus dem richtigen Leben“, die den Effekt von Bulevirtid außerhalb von Studien belegen. In einer europäischen Multicenter-Studie war nach 48 Wochen die ALT bei 77% normal, die HDV-RNA bei 10% negativ und beides erreichten 54% der Patienten. In Hannover wurden 109 Patienten beobachtet, vorgestellt wurden 24-Wochen-Daten von 26 Patienten. Bei 42% fiel die Delta-RNA um mindestens 2log-Stufen, bei 15% weniger als 1 log-Stufe. Die Gallensäuren stiegen im Verlauf der Therapie, wobei das Ausmaß des Anstiegs nicht mit dem Ansprechen korrelierte, wohl aber der Ausgangswert. In einer französischen prospektiven Kohorte BuleDelta werden etwa die Hälfte der Patienten mit Bulevurtid mit bzw. ohne Interferon behandelt. Das Ansprechen war in beiden Armen gut, in der Interferon-Gruppe sogar etwas besser (Buti M et al., SAT379; Deterding K et al., SAT341; Fontaine H et al., OS093).










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
