The International Liver Congress™ 2011 by EASL,
30. März - 3. April 2011 Berlin
Neue Ära in der Behandlung der Hepatitis C
Hepatitis C
Nachdem es seit gut einem Jahrzehnt nach der Zulassung von Ribavirin kein neues HCV-Medikament mehr gab, wird in den nächsten Jahren eine Welle neuer Substanzen für die HCV-Therapie anrollen - zur Zeit entwickeln etwa 30 verschiedene Unternehmen HCV-Medikamente, die an unterschiedlichen Wirkorten ansetzen. Am weitesten in der Entwicklung fortgeschritten sind der Proteasehemmer Boceprevir (voraussichtlicher Handelsname Victrelis®) und Telaprevir (voraussichtlicher Handels-name Incivek®). Kurz nach dem EASL 2011 empfahl das Advisory Board für antivirale Medikamente der amerikanischen Arzneimittelbehörde FDA jeweils einstimmig die Zulassung von Boceprevir und Telaprevir für therapienaive und vorbehandelte Patienten mit chronischer Hepatitis C Genotyp 1. Mit der Kombination Boceprevir oder Telaprevir und der Standardtherapie pegyliertes Interferon und Ribavirin (pegIFN/RBV) steigern sich die Heilungsraten (Sustained Virological Response; SVR, d.h. auch sechs Monate nach Ende der Therapie anhaltend supprimierte HCV-RNA): Bei therapienaiven Patienten unter Boceprevir auf 67 % und unter Telaprevir auf 79 % versus rund 50 % unter pegIFN/RBV sowie bei vorbehandelten Relapsern und partiellen Respondern unter Boceprevir 59-66 % und unter Telaprevir 54-83 % (hier auch 29-33 % bei den Nullrespondern) versus etwa 25 % unter pegIFN/RBV (AASLD 2010 und NEJM 2011). Bis zu zwei Drittel der therapienaiven Patienten konnte die Tripletherapie in den Phase-III-Studien verkürzen, weil die Viruslast früh und anhaltend supprimiert war (Response-gesteuerte Therapie, RGT). Beide Proteasehemmer müssen dreimal am Tag als Tablette eingenommen werden. Substanzspezifische Nebenwirkungen von Boceprevir sind Anämie und schlechter Geschmack, und von Telaprevir Anämie und Hautausschlag. Der Boceprevir-Tripletherapie (24 oder 44 Wochen) wurde eine vierwöchige Lead-in-Phase jeweils mit pegIFNalpha-2b/RBV vorangestellt. Die 12-wöchige Telaprevir-Tripletherapie erhielten die Patienten von Anfang an, gefolgt von 12 oder 36 Wochen pegIFNalpha-2a/RBV. Die HCV-Therapie wird also wirksamer, aber auch viel komplexer.
Auf dem EASL 2011 wurden zu den beiden Proteasehemmern Substudien aus den Zulassungsstudien und weitere Phase-III-Studien vorgestellt.
Boceprevir plus pegIFN alpha-2a wirkt auch
In einer Phase-III-Studie (gleiche Einschlusskriterien wie Zulassungsstudie RESPOND-2) wurde geprüft, ob Boceprevir (BOC) auch mit pegIFN alpha-2a kombiniert werden kann. Doppelblind und plazebokontrolliert erhielten die vorbehandelten Patienten mit chronischer HCV Genotyp 1 entweder BOC plus pegIFNalpha-2a/RBV (n=134) oder pegIFNalpha-2a/RBV (n=67)(Flamm S et al. Abstract #1366). Die 48-wöchige Tripletherapie steigerte im Vergleich zur Standardtherapie die SVR-Rate um das Dreifache (64 versus 21 %; p<0,0001)und bestätigte damit die SVR-Raten aus RESPOND-2 (Abb. 1). Auch die früheren partiellen Responder (Abnahme der Viruslast um 2 Logstufen bis Woche 12, aber nach wie vor nachweisbar Woche 24) und früheren Relapser (Wiederanstieg der zuvor nicht nachweisbaren Viruslast nach Ende der Therapie) erreichten in in dieser Studie mit pegIFN alpha-2a vergleichbare Werte wie in RESPOND-2 mit pegIFN alpha-2b.
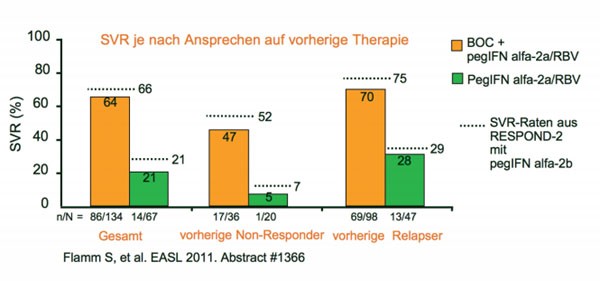
Abb. 1 Phase-III-Studie: Boceprevir plus pegIFNalpha-2a/RBV
Boceprevir auch bei Zirrhose wirksam
Eine Subanalyse der beiden Phase-III-Studien SPRINT-2 (1.097 therapienaive Patienten) und RESPOND-2 (403 vorbehandelte Patienten) ergab ebenfalls hohe SVR-Raten bei Patienten mit fortgeschrittener Fibrose/Zirrhose (SPRINT-2 n=100 und RESPOND-2 n= 78) (Bruno S et al. Abstract #7). Eine SVR erreichten unter der Tripletherapie je nach Fibrosegrad 41-52 % (SPRINT-2) und 44-68 % (RESPOND-2) der Patienten im Vergleich zu 12-18 % bzw. 16-28 % in den Standardtherapie-Armen (Abb.2). Das frühe Ansprechen nach der vierwöchigen Tripletherapie (Woche 8 HCV-negativ; rapid viral response, RVR) war auch bei diesen Patienten mit fortgeschrittener Lebererkrankung mit einer SVR assoziiert. Bei Vorliegen einer RVR erreichten Patienten mit und ohne fortgeschrittene Lebererkrankung jeweils vergleichbare Heilungsraten. Für Patienten mit Fibrosegrad 3/4 war die 48-wöchige Therapie wirksamer als die kürzere Response-gesteuerte Therapie (RGT). Nebenwirkungen traten bei den Patienten mit Fibrose/Zirrhose nicht häufiger auf.
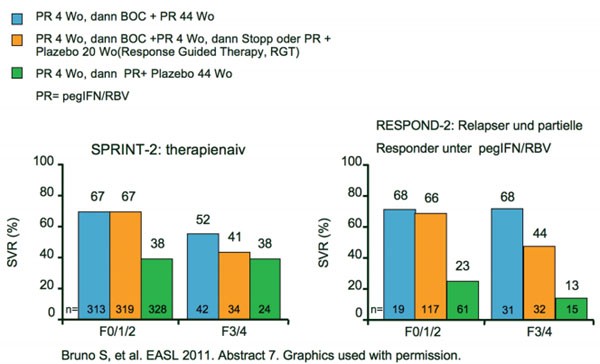
Abb. 2 SPRINT-2 und RESPOND-2: Subanalysen SVR bei fortgeschrittener Fibrose/Zirrhose
Telaprevir bei Therapieversagern
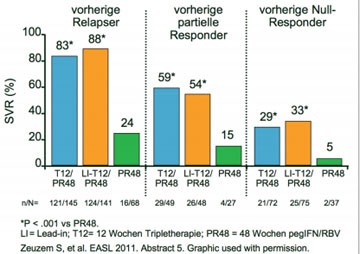
Abb. 3 REALIZE: SVR Raten je nach vorherigem Therapieansprechen
Vorbehandelte Patienten erreichten mit Telaprevir (TLV) und pegIFNalpha-2b/RBV hohe Heilungsraten, eine vorgeschaltete Lead-in-Phase hatte jedoch keinen Einfluss auf die SVR- und Relapse-Raten. Das ergaben die endgültigen Ergebnisse der Studie REALIZE, in der 662 mit pegIFN/RBV vorbehandelte Patienten Genotyp 1 eingeschlossen wurden (Zeuzem S et al. Abstract #5). Von ihnen waren 28 % vorherige Nullresponder (Abfall der Viruslast <1 Logstufe), 19 % partielle Responder und 54 % Relapser. Die Patienten wurden randomisiert einer von drei Gruppen zugeordnet: 12 Wochen TLV plus pegIFN/RBV und anschließend 36 Wochen pegIFN/RBV, 4 Wochen pegIFN/RBV (Lead-in-Phase) und anschließend 12 Wochen mit TLV plus pegIFN/RBV gefolgt von 32 Wochen oder 48 Wochen pegIFN/RBV. Die SVR-Raten betrugen bei den Nullrespondern 29 % bzw. 33 % versus 5 %, bei den partiellen Respondern 59 % bzw. 54 % versus 15 % und bei den Relapsern 83 % bzw. 88 % versus 24 % (Abb. 3). Vorherige partielle und Null-Responder mit fortgeschrittener Fibrose und mit Zirrhose sprachen schlechter auf die Triple-Therapie an als Patienten mit keiner bis leicht fortgeschrittener Lebererkrankung.
Das Ansprechen auf die vorherige Therapie war in der Studie REALIZE ein besserer Prädiktor für eine Heilung als das Ansprechen auf die Lead-in-Phase mit pegIFN/RBV (Foster GR et al. Abstract #6).
IL28B bei Proteasehemmern
Ein genetischer Polymorphismus im Gen
für Interleukin 28 (IL28B) beeinflusst je nach Genotyp (CC, CT oder TT) der
Patienten das Ansprechen auf eine Therapie mit pegIFN/RBV. Ob der IL28B-Genotyp
auch in Anwesenheit von Boceprevir die SVR beeinflusst, wurde retrospektiv in
den Studien SPRINT-2 und RESPOND-2 untersucht (Poodard F et al. Abstract #12).
Das Ergebnis: Der IL28B-Status ist ein Prädiktor für die SVR (Abb. 4) und
korrelierte mit dem Ansprechen auf die 4-wöchige Lead-in-Phase, aber auch mit
der RVR nach vier Wochen Tripletherapie (Woche 8). Das Ansprechen auf die
Lead-in-Phase war der stärkste Prädiktor für eine SVR, inklusive IL28B. Die
höchste SVR-Rate wurde unabhängig vom IL28B-Genotyp beobachtet, wenn die
Viruslast nach der 4-wöchigen Lead-in-Phase um mindestens eine Logstufe abnahm.
Bei rund 90 % der
therapienaiven und rund 80 % der
vorbehandelten Patienten mit dem günstigen Genotyp CC konnte die Therapie
verkürzt werden.
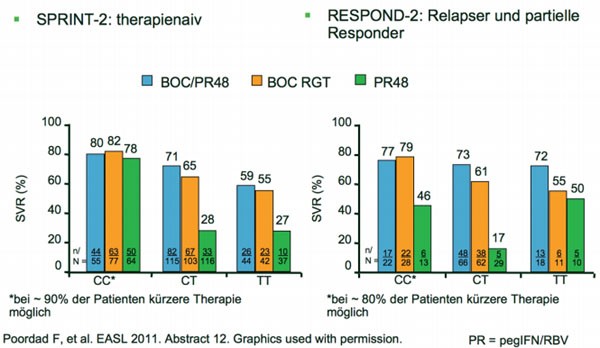
Abb. 4 SPRINT-2 und RESPOND-2: IL28B als Prädiktor für Therapieansprechen
Für Telaprevir zeigte sich dagegen kein Einfluss des IL28B-Status auf die SVR. In REALIZE betrug die SVR-Rate unter Telaprevir für den Genotyp CC 79 % in der retrospektiven Auswertung und war numerisch höher als für CT (60 %) und TT (61 %)(Pol S et al. Abstract#13). Das Ansprechen auf die vorherige IFN/RBV-Therapie und die jetzige Triple-Therapie korrelierte besser mit der SVR als der IL28B-Genotyp. In einer Subanalyse der Studie ADVANCE (therapienaive Patienten) konnten Plasmaproben von 42 % der Patienten (454/1.088) hinsichtlich des IL28B-Status ausgewertet werden. Bei den therapienaiven Patienten war das Erreichen einer SVR unabhängig vom IL28-Status (Jacobson I et al. Abstract #1369). Telaprevir erhöhte bei allen IL28B-Genotypen die SVR. Patienten mit Genotyp CC hatten jedoch eine größere Chance auf eine RVR und eine Verkürzung der Therapie (Abb. 5).
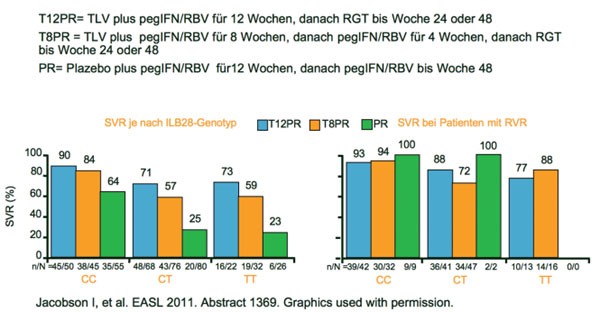
Abb. 5 ADVANCE: IL28B-Genotyp CC tendenziell besser bei therapienaiven Patienten
Resistenzen gegen Proteasehemmer
Das Auftreten von Resistenzen in den Boceprevir-Studien war mit einem mangelnden Ansprechen auf die Therapie assoziiert. So konnten bei 68 % der Patienten aus SPRINT-2 und RESPOND-2 mit schlechtem Ansprechen auf die Lead-in-Phase Resistenz-assoziierte Viren nachgewiesen werden im Vergleich zu 31 % der Patienten, die zunächst gut auf diese Phase ansprachen (Zeuzem S et al. Abstract#9). Viren des Genotyps 1a entwickelten mehr Resistenzen als Genotyp 1b.
Die Resistenzentwicklung unter Telaprevir wurde bei 388 Patienten, die in den Studien ADVANCE und ILLUMINATE (therapienaive Patienten) sowie REALIZE (vorbehandelte Patienten) keine SVR erreicht hatten, untersucht (Sullivan JC et al. Abstract #8). Zum Zeitpunkt des Therapieversagens hatten 26 % der Patienten Wildtyp-Viren und 74 % die Resistenz-assoziierten Virusvarianten (RAVs) V36A/M, T54A/S, R155K/T und A156S/T/V. Die Patienten mit RAVs wurden zwischen 2 Wochen und 16 Monaten nachbeobachtet. Nach einem Jahr wurde bei 71 % und nach 16 Monaten bei 96 % der Patienten wieder Wildtyp-Virus nachgewiesen. Das Resistenzprofil der HCV-Genotypen 1a und 1b unterschied sich: Beim Genotyp 1a waren die Mutationen V36M, R155K und V36M + R155K, und beim Genotyp 1b V36A, T54A und A156S/T vorherrschend. Im Mittel dauerte es sieben Monate, bis die RAVs nicht mehr nachweisbar waren, wobei Varianten von Genotyp 1b deutlich schneller verschwanden als RAVs vom Genotyp 1b (Median 0,8 versus 10 Monate).
SILEN-C1 und SILEN-C2
Präsentiert wurden die Ergebnisse zweier
doppelblinder Phase-II-Studien mit dem einmal täglich einzunehmenden
Proteasehemmer BI201335. In der Studie SILEN-C1 erhielten 429 Patienten
entweder die Standardtherapie pegIFN/RBV, BI201335 240mg QD plus pegIFN/RBV
oder nach einer dreitägigen Lead-in-Phase mit pegIFN/RBV BI201335 240mg QD plus
pegIFN/RBV oder BI201335 120mg QD plus pegIFN/RBV (Abb. 6) (Sulkowski M et al.
Abstract #60). Die Triple-Therapie wurde 24 Wochen gegeben und anschließend je
nach Ansprechen für weitere 24 Wochen pegIFN/RBV. Insgesamt 83 % der Patienten erreichten eine SVR mit
240mg BI201335 (Abb. 7), davon konnten 87 %
der Patienten die Therapie nach 24 Wochen beenden. Die dreitägige Lead-in-Phase
erhöhte das virologische Ansprechen nicht. Die häufigsten
dosisabhängigen unerwünschten Ereignisse waren gastrointestinale
Nebenwirkungen, Ikterus aufgrund einer isolierten indirekten
Hyperbilirubinämie, leichter Hautausschlag und Lichtempfindlichkeit.
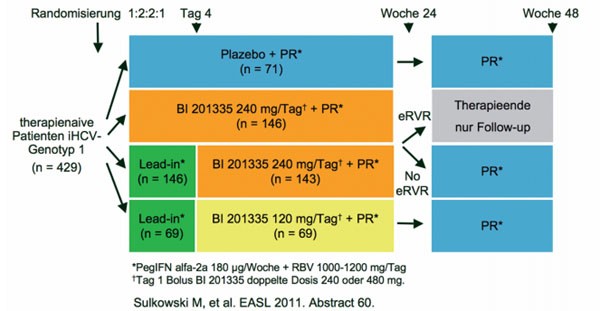
Abb. 6: SILEN-C1: BI 201335 plus PegIFN/RBV bei therapienaiven Patienten
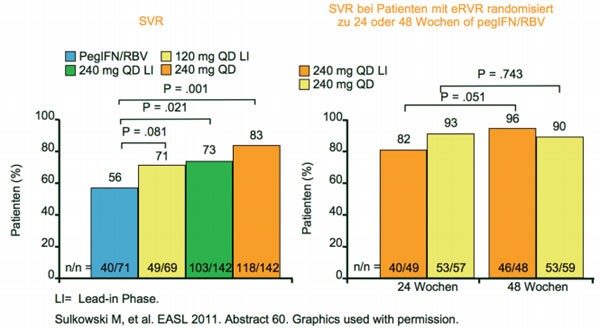
Abb. 7 SILEN-C1: höhere SVR-Raten mit 240mg QD BI201335. 3-tägige Lead-in-Phase hat keinen Effekt
In der Studie SILEN-C2 erhielten 288 Patienten, die auf eine vorherige pegIFN/RBV nicht angesprochen hatten, entweder nach einer dreitägigen Lead-in-Phase oder ohne Lead-in-Phase 240mg QD BI201335 plus pegIFN/RBV für 24 Wochen oder nach einer dreitägigen Lead-in-Phase 240mg BID BI201335 plus pegIFN/RBV für 24 Wochen. Je nach Therapieansprechen folgte pegIFN/RBV für weitere 24 Wochen (Sulkowski MS et al. Abstract #66). Mit 240mg QD BI201335 erreichten 41 % der Patienten eine SVR, bei den partiellen Respondern war das bei 50 % und bei den Nullrespondern bei 35 % der Fall. Die Verkürzung der Therapie bei Patienten mit raschem Ansprechen (eRVR) war ungünstig. Und auf die dreitägige Lead-in-Phase sprachen in dieser Patientenpopulation weniger Patienten an als ohne Lead-in.
Weiterentwickelt wird der Proteasehemmer in der Dosierung 240mg QD.
Cyclophillin-Inhibitor Alisporivir
Hepatitis-C-Viren benötigen für ihre Vermehrung das wirtseigene Protein Cyclophillin A, das vom Cyclosporin-Abkömmling Alisporivir (früher Debio 025) gehemmt wird. Dieser hat eine höhere Affinität zum Cyclophillin, aber eine geringere Immunaktivität als Cyclosporin. Die Vorteile dieses Wirkansatzes: Da die Substanz die Virusvermehrung nicht direkt über die Blockade von Proteasen oder Polymerasen hemmt, sondern über ein wirtseigenes Enzym, spielen weder der HCV-Genotyp noch Resistenzmutationen der viralen Enzyme eine Rolle.
Die 48-wöchige Tripletherapie aus Alisporivir QD und pegIFN/RBV war bei therapienaiven Patienten in der Phase-IIb-Studie ESSENTIAL der 48-wöchigen Standardtherapie pegIFN/RBV unabhängig vom ILB28B-Genotyp überlegen (SVR-Rate 76 versus 55 %) (Flisiak R et al. Abstract #4). Beim ungünstigen IL28B-Genotyp TT verdoppelte sich die SVR-Rate mit Alisporivir. Eine 24- wöchige Tripletherapie reichte für eine SVR bei den Patienten aus, die schnell auf die Therapie ansprachen, und mit einer RVR ansprachen. Insgesamt brachen nur wenige Patienten die Studie wegen Nebenwirkungen ab (5 % versus 4 %). Unter Alisporivir traten bei 4,2 % der Patienten eine transiente Hyperbilirubinämie (Gesamtbilirubin ≥5xULN) auf, die sich innerhalb von vier Wochen zurückbildete.
NUCLEAR: Interferonfreie Therapie
In einer Proof-of-Concept-Studie der
Phase I wurde das erste Mal das Purin-Nukelotidanalogon PSI-938 und das
Pyrimidin-Nukleotidanalogon PSI-7977 an 30 therapienaiven HCV-Patienten Genotyp
1 als Monotherapie und als Zweierkombination untersucht (Lawitz E et al.
Abstract #1370). Die Viruslast zu Baseline betrug 6,2-7,0 Logstufen. Sowohl
unter den Monotherapien als auch der Kombiantionstherapie nahm die Viruslast
bereis nach drei Tagen deutlich ab. Nach 14 Tagen Monotherapie hatten 50 bzw.
63 % der Patienten
eine nicht nachweisbare Viruslast. Die Zugabe der zweiten Substanz nach sieben
Tagen erhöhte die Anzahl der Patienten mit nicht nachweisbarer Viruslast auf 94
bzw. 100 %. In allen
Gruppen sank die Viruslast im Median um 5-5,2 Logstufen. Die Verträglichkeit
der Kombination war gut, die beiden Substanzen antagonisierten sich nicht
gegenseitig und es trat kein viraler Durchbruch auf. Eine Phase-II-Studie wird
die Kombination der beiden Nukleotidanaloga mit unterschiedlicher Therapiedauer
bei HCV-Patienten aller Genotypen untersuchen.
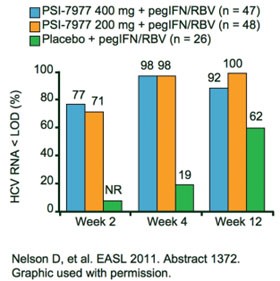
Abb. 8 PROTON: PSI-7977 plus pegIFN/RBV bei therapienaiven Patienten Genotyp 1
Dass PSI-7977 eine hohe genetische Barriere hat und gegen alle Genotypen wirksam ist, wurde in Zwischenauswertungen der Studie PROTON gezeigt. Unter PSI-7977 400mg QD plus pegIFN/RBV war die Viruslast bis Woche 12 nach Ende der Therapie anhaltend supprimiert (SVR12) (Lalezari J et al. Abstract #61). In der Interimsanalyse der Patienten mit Genotyp 1 hatten unter der Tripletherapie mit PSI-7977 400mg QD 92 % und unter mit 200mg QD 100 % der Patienten eine nicht nachweisbare Viruslast versus 62 % unter pegIFN/RBV alleine (Abb. 8) (Nelson DR et al. Abstract #1372).
Viererkombination: 100% SVR bei Nullrespondern
In einer kleinen Studie mit 21 Patienten, die zuvor nicht auf pegIFN/RBV ansprachen, wurde die Kombination aus dem NS3-Proteasehemmer BMS-650032 (600mg BID) und dem neuartigen NSA5-Replikationskomplex-Inhibitor BMS-790052 (60mg QD) mit und ohne pegIFN/RBV untersucht (Lok A et al. Abstract #1356). Insgesamt 19 Patienten hatten einen ungünstigen ILB28-Genotyp. Die Zweier- bzw. Viererkombination erhielten die Patienten jeweils 24 Wochen lang. 100 % der Patienten (10/10) unter der Viererkombination erreichten eine SVR12 und unter der Zweierkombination immerhin 36 % (4/11). Mit der Viererkombination kam es zu keinem viralen Durchbruch. Mit der Zweierkombination hatten 6/11 Patienten einen viralen Durchbruch, alle hatten den Genotyp 1a und es konnten bei ihnen resistente Varianten nachgewiesen werden. Die Kombinationen waren gut verträglich, bei sechs Patienten erhöhten sich die Transaminasen vorübergehend.
Interferon lambda besser
In der Studie EMERGE (526 Patienten mit
HCV-Genotyp 1, 2, 3 und 4) wurde das neue pegylierte Interferon lambda (120,
180 und 240μg) direkt mit pegyliertem Interferon alpha-2a (180μg) verglichen,
jeweils in Kombination mit Ribavirin. Vorgestellt wurden die Ergebnisse der
12-wöchigen verblindeten Phase (Zeuzem S et al. Abstract #1360). Ein komplettes
frühes Ansprechen (complete early virological response, cEVR, d.h. nicht
nachweisbare Viruslast zu Woche 12) hatten 55-56 % der Patienten aus der
pegIFN-lambda-Gruppe und 38 % aus der
pegIFN-alpha-Gruppe. Bei den Patienten mit den Genotypen 2 und 3 war das bei
83-97 % versus 86 % der Fall (Abb. 9). Bei 5,9 % (12,7 % bei 240μl) der Patienten musste die
Dosis von pegIFN lambda und bei 18,8 %
der Patienten die Dosis von pegIFN alpha reduziert werden. Ribavirin wurde
reduziert oder beendet bei 8,7 % der Patienten
aus der pegIFN-lambda-Gruppe und bei 20,3 %
der Patienten aus der pegIFN-alpha-Gruppe. Der Unterschied der beiden
Interferone zeigte sich vor allem auch bei den Nebenwirkungen: Unter
pegIFN-lambda berichteten weniger Patienten über Grippe-ähnliche Beschwerden
(10 % versus 43 %), Muskelschmerzen (15 % versus 46 %) und Anämien (15 % versus 44 %). Unter pegIFN lambda traten häufiger
erhöhte Transaminasen (14,4 % versus 7,6 %) und erhöhtes Bilirubin (12,1 % versus 1,5 %) auf. Die bessere Verträglichkeit von
pegIFN lambda lässt sich auf die unterschiedliche Verteilung der jeweiligen
Rezeptoren zurück führen: Die Rezeptoren von Interferon alpha sind an Zellen
überall im Körper vorhanden, die von Interferon lambda werden dagegen wird der
fast ausschließlich von Hepatozyten exprimiert.
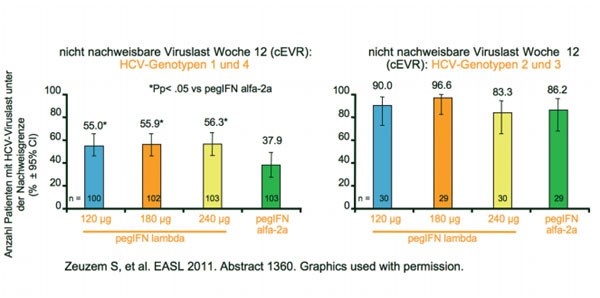
Abb. 9 EMERGE: pegIFN-lambda versus pegIFN-alfa-2a bei therapienaiven Patienten mit HCV-Genotyp 1-4
HCV-Impfung induziert Impfantwort
Das erste Mal wurden Ergebnisse einer therapeutischen und einer prophylaktische Vakzine gegen Hepatitis C (HCV) mit neuen andenoviralen Vektoren vorgestellt. Die Adenovektoren der beiden Prime-Boost-Impfungen basieren auf seltenen humanen und simianen Serotypen, die für nicht-strukturelle HCV-Proteine codieren.
Insgesamt zehn HCV-Patienten mit HCV-Genotyp 1 wurden zusätzlich zu pegIFN/RBV therapeutisch geimpft: Sie erhielten zunächst eine oder zwei erste Impfungen mit dem simianen Adenovektor (prime) und zehn Wochen später eine weitere Impfung mit dem humanen Adenovektor (boost)(Kelly C et al. Abstract #65). Bei der Hälfte der Patienten wurde eine HCV-spezifische Immunantwort mit maximaler T-Zellzahl zwei bis acht Wochen nach der Boost-Impfung nachgewiesen.
Die prophylaktische Vakzine erhielten 27 Probanden zunächst als zwei Prime-Impfungen mit demselben Vektor im Abstand von vier Wochen und nach 24 Wochen eine Boost-Impfung mit dem jeweils anderen Vektor (Barnes E et al. Abstract #1140). Nach der ersten Impfung konnte für beide Adenovektoren bereits eine Impfantwort nachgewiesen werden. Die Immunogenität der Prime-Impfungen mit dem humanen Vektor und anschließender Boost-Impfung mit dem siminanen Vektor wirkte am stärksten. Nachgewiesen wurden polyfunktionale CD4+- und CD8+- HCV-spezifische T-Zellantworten, die auch noch am Ende des Beobachtungszeitraumes von 52 Wochen nach der letzten Impfung anhielten.
Bei beiden Impfstrategien traten nur leichte bis mittelschwere lokale und systemische Reaktionen auf, ein schwerwiegendes unerwünschtes Ereignis wurde nicht beobachtet.
Hepatitis B
Entecavir in der Praxis
Mittlerweile können mit Entecavir zur Behandlung der chronischen Hepatitis B (CHB) unter Praxisbedingungen vier Jahre Behandlung überblickt werden. In einer aktuellen Auswertung einer chinesischen Kohorte hatten nach vier Jahren 91,2 % der verbliebenen Patienten eine Viruslast unter der Nachweisgrenze (Seto WK et al. Abstract #748). Von den 90 HBeAg-positiven Patienten erreichten in dieser Zeit 51,4 % eine HBeAg-Serokonversion. Nur ein Patient (0,6 %) entwickelte eine Resistenz gegen Entecavir. Die Analyse umfasst die Daten von 222, 188, 172 bzw. 70 Patienten, die 1,2,3 bzw. 4 Jahre mit einmal täglich 0,5mg Entecavir behandelt wurden.
Laut einer aktuellen Auswertung einer europäischen Kohorte mit 333 Patienten (therapienaiv n= 243, mit Adefovir vorbehandelt n=90) war nach im Median 20 Monaten bei 81 % der therapienaiven und 62 % der vorbehandelten Patienten die Viruslast nicht nachweisbar (Zoutendijk R et al. Abstract #760). Bei den mit Adefovir-vorbehandelten Patienten wirkte die Entecavir-Therapie in Abwesenheit von Lamivudin-Resistenzen.
Tenofovir in der Praxis
Auch für Tenofovir, das seit zehn Jahren in der HIV-Therapie eingesetzt wird, gab es aktuelle Analysen zu Langzeitdaten bei HBV-Therapie über vier Jahre aus dem Praxisalltag. In einer europäischen Kohortenstudie hatten 90 % von 302 therapienaiven Patienten nach 21 Monaten Behandlung nach wie vor eine Viruslast unter der Nachweisgrenze (Lampertico P et al. Abstract #731). Insgesamt 79 % der Patienten waren zu Studienbeginn HBeAg-negativ, 35 % hatten bereits eine Zirrhose und 45 % eine Begleiterkrankung bzw. -medikation.
Eine andere italienische Arbeitsgruppe wertete die Daten von 85 Patienten aus, die virologisch unzureichend (>1.000 HBV-DNA-Kopien/ml nach 48 Wochen) auf eine Adefovir-Monotherapie oder auf Adefovir plus Lamivudin ansprachen, und deren Therapie deshalb auf Tenofovir (n=13) bzw. Tenofovir plus Lamivudin (n=72) umgestellt wurde (Levrero M et al. Abstract #732). Mehr als 90 % der Patienten hatte HB-Viren mit Resistenzmutationen gegen Adefovir, Lamivudin oder Entecavir. Nach Umstellen auf Tenofovir bzw. Tenofovir plus Lamivudin war nach 96 Wochen bei 83 % der Patienten komplett supprimiert (HBV-DNA <12IU/ml).
Reaktivierung bei Chemotherapie
Eine Reaktivierung der HBV-Infektion ist eine schwere Komplikation unter einer Chemotherapie mit Rituximab. Fulminante Verläufe kommen auch bei HBsAg-negativen Patienten vor, deshalb wird eine Prophylaxe mit einem Nukleosidanalogon empfohlen. Bislang war Lamivudin Mittel der Wahl, aber auch Entecavir kann eine Reaktivierung verhindern, wie eine japanische Arbeitsgruppe bei 327 Patienten mit B-Zell-Lymphom nachwies (Kojima H et al. Abstract #728).
HBV-DNA als Prädiktor für HCC
Die Abnahme der HBV-DNA unter die
Nachweisgrenze ist der wichtigste Prädiktoren für die Abnahme des Leberkrebs-Risikos,
wie eine Langzeitbeobachtung von mehr als 1.000 Patienten mit chronischer HBV
ergab (Liu J et al. Abstract #68). Zwischen 1991 und 1992 wurden 1.285
Patienten mit einer Viruslast von ≥100.000 HBV-DNA-Kopien/ml in die Kohorte
eingeschlossen und bis Ende 2007 nachverfolgt. In dieser Zeit wurde bei 111
Patienten ein HCC neu diagnostiziert (19.321 Personenjahre). In der
multivariaten Analyse war eine nicht nachweisbare Viruslast der beste Prädiktor
für ein geringeres HCC-Risiko (adjustiertes HR 0.28) (Abb. 10). Kein
Unterschied für das HCC-Risiko zeigte sich bei Patienten mit und ohne Verlust
von HBeAg und HBsAg. Bei den Patienten mit nicht nachweisbarer HBV-DNA war mit
und ohne HBsAg-Verlust das HCC-Risiko vergleichbar (kumulative HCC-Inzidenz 1,6
und 1,9 %, p00,89).
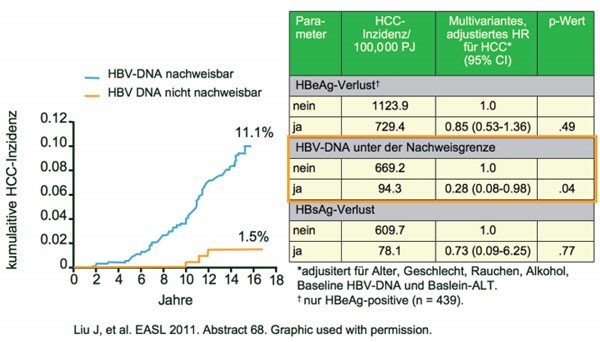
Abb. 10 Persistenter HBV-DNA Prädiktor für ein HCC
HBsAg-Titer unter pegIFN
Eine weitere Auswertung der Studie NEPTUNE zeigt, dass die HBsAg-Titer während der Therapie mit einem anhaltenden Therapieansprechen korrelieren (Gane E et al. Abstract #69). Von den 114 HBeAg-positiven Patienten (548 Studienteilnehmer) mit messbaren HBsAg-Werten erreichten 37,6 % eine HBeAg-Serokonversion sechs Monate nach Therapieende. Im Vergleich zu den Non- Respondern sank bei diesen Patienten der HBsAg-Titer mit Therapiebeginn deutlicher(-1,34 versus -0,61 Logstufen IU/ml). Mit einem HBsAg-Wert von <1.500 IU/ml erreichten 27 % bzw. 40 % der Patienten zu Woche 12 bzw. Woche 24, was mit einem anhaltenden Therapieansprechen assoziiert war. Die Wahrscheinlichkeit, eine HBeAg-Serokonversion mit einer 48wöchigen pegIFN-Therapie zu erreichen, war bei Patienten mit einem HBsAg-Titer von >20.000 IU/ml zu Woche 12 und 24 gering, so dass bei diesen Patienten die pegIFN-Therapie frühzeitig abgebrochen werden kann.
IL28B-Status auch bei HBV wichtig
Ob der IL28B-Polymorphismus einen Einfluss auf das Ansprechen von HBeAg-positiven HBV-Patienten auf pegIFN hat, wurde bei 205 Patienten mit chronischer HBV (65 % Asiaten, 29 % Kaukasier) untersucht (Sonneveld MJ et al. Abstract #71). Die Patienten wurden mit pegIFN (n=191) oder konventionellem IFN (n=14) behandelt. Am häufigsten hatten die Patienten mit HBV-Genotyp C eine HBeAg-Serokonversion (47 %), gefolgt von B (20 %), A (13 %) und D (13 %). Je günstiger der IL28B-Genotyp umso höher war das Ansprechen mit einer HBeAg-Serokonversion: 50 %, 29 % bzw. 10 % für CC, CT bzw. TT und 51 %, 26 % bzw. 10% für AA, AG bzw GG.










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
