Zulassungsstudien für Boceprevir: SPRINT-2 und RESPOND-2
SPRINT-2: Verkürzte Therapiedauer mit Boceprevir ...
RESPOND-2: Boceprevir erhöht signifikant SVR-Rate ...
Weiterer Beitrag zum Thema:
Hepatitis&more
Boceprevir: SPRINT-2 und RESPOND-2
In den beiden doppelblinden, plazebokontrollierten Phase-III-Studien SPRINT-2 mit 1.097 therapienaiven HCV-Patienten Genotyp 1 und RESPOND-2 mit 403 vorbehandelten HCV- Patienten Genotyp 1 wurden zwei verschiedene Triple-Therapien aus Boceprevir (BOC), Peginterferon alfa-2b (pegIFN) und Ribavirin (RBV) verglichen, als Kontrolle diente die Standardtherapie pegIFN/RBV über 48 Wochen (48P/R):
- Response-gesteuerte Therapie (BOC RGT), in der die Dauer der Therapie vom frühen Ansprechen (ab Woche 8 HCV-RNA im Blut negativ) abhängt: Nach einer vierwöchigen Einleitungsphase mit 1,5μg/kg/Woche Peginterferon alfa-2b plus 600-1400 mg/Tag Ribavirin je nach Körpergewicht (pegIFN/RBV) erhielten die Patienten für 24 Wochen 3x täglich 800mg Boceprevir plus pegIFN/RBV und falls die Viruslast zwischen Woche 8 und 24 nachweisbar war für weitere 20 Wochen pegIFN/RBV. Therapienaive Patienten mit frühem Ansprechen beendeten die RGT nach 28 Wochen (20 Wochen eher) und vorbehandelte Patienten mit frühem Ansprechen nach 36 Wochen (12 Wochen eher).
- 48-wöchige Therapie (BOC/PR48: Nach der 4-wöchigen Einleitungsphase pegIFN/RBV erhielten die Patienten für 44 Wochen BOC plus pegIFN/RBV.
In
SPRINT-2 wurden die Patienten im Verhältnis 1:1:1 und in RESPOND-2 im
Verhältnis 1:2:2 auf die drei Arme randomisiert. Patienten, die auch nach 12
Wochen nicht auf die Therapie ansprachen, beendeten die Studie als
Therapieversager vorzeitig.
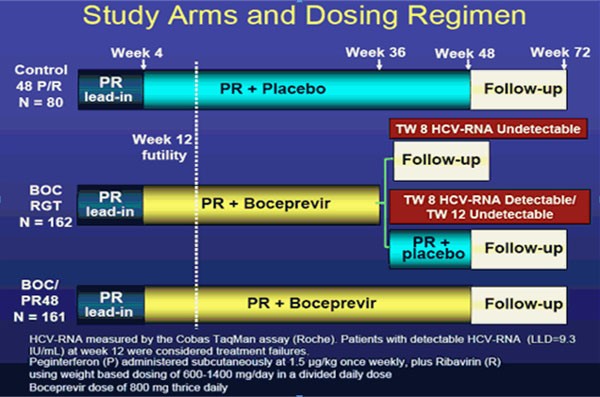
Abb.: RESPOND-2 Studiendesign (gleiches Studiendesign bei SPRINT-2)
Erste Ergebnisse zum primären Endpunkt wurden bereits im August 2010 veröffentlicht:
SPRINT-2: Die SVR-Rate (sechs Monate nach Ende der Therapie nach wie vor HCV-RNA negativ) betrug nach der Standardtherapie 38%(137/363 Patienten), nach der RGT 63% (233/368 Patienten) und nach der 48-wöchigen Triple-Therapie 66% (242/366 Patienten).
RESPOND-2: Die SVR-Rate betrug nach der Standardtherapie 21% (17/80 Patienten), nach der RGT 59% (65/162 Patienten) und nach der 48-wöchigen Triple-Therapie 66% (107/161 Patienten).
http://hepatitisandmore.de/aktuell/2010-08/boceprevir.shtml










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
