Johannes R. Bogner, München
Firstlinetherapie Differenzialtherapie mit Proteasehemmern
Proteaseinhibitoren (PI) sind eng verbunden mit dem Durchbruch in der HIV-Therapie Mitte der 90er Jahre, der für viele HIV-Patienten zur Lebensrettung wurde. Auch heute sind sie ein unverzichtbarer Teil der antiretroviralen Therapie (ART). Neben der klassischen Kombination mit zwei NRTI sind auch weitere Möglichkeiten der PI-Therapie in der Erprobung (Monotherapie, duale Therapie). Aufgrund einiger Vorteile von PI wird in Deutschland ein hoher Anteil von Patienten in ihrem ersten Therapieregime mit dieser Substanzklasse behandelt. Zu den Vorteilen zählen die robuste antivirale Wirkung mit geringer Resistenzentwicklung, eine hohe Resistenzbarriere, die Sicherheit beim möglichen Vorliegen von Primärresistenzen und bei einigen Präparaten die einmal tägliche Gabe. Nachteile umfassen die höhere Tablettenzahl und das Interaktionspotenzial am Cytochrom p450 durch den PI selbst und/oder des Ritonavir-Boosters. In der Ausgabe von HIV&more 4/2012 brach Christian Hoffmann, Hamburg, ein Lanze für den Einsatz von PI.9 Hier geht es nun um die den Vergleich der für die Primärtherapie geeigneten Substanzen.
Erste Proteasehemmer
PI sind spezifische Hemmstoffe der Enzymaktivität der HIV-eigenen Protease. Die Aufschlüsselung der molekularen Struktur und Tertiärstruktur dieses Enzyms ermöglichte ein Moleküldesign mit dem Ziel einer möglichst guten Bindung an das aktive Zentrum der Protease um deren Wirkung am HIV-Präkursor-Protein zu unterbinden. Durch die fehlende Spaltung in funktionelle Strukturproteine kommt es zur Bildung von nicht replikationsfähigen Viruspartikeln, wodurch die Replikation unterbunden ist. Ritonavir (Norvir®), Saquinavir (Invirase®) und Indinavir (Crixivan®) waren die ersten Vertreter der Substanzklasse der Proteasehemmer. Indinavir kommt heute kaum mehr zum Einsatz und Ritonavir spielt nur noch eine Rolle als Booster-Substanz in Kombination mit anderen PI. Saquinavir gehört nach wie vor zum Repertoire der eingesetzten PI. Nelfinavir wird kaum mehr eingesetzt (keine Booster-Möglichkeit, 10 Tabletten am Tag) und wird ab 2013 in Deutschland nicht mehr vermarktet. Indinavir, Ritonavir und Nelfinavir werden daher hier nicht mehr separat besprochen. Der PI Tipranavir (Aptivus®) ist nicht zur Firstlinetherapie zugelassen, sondern dient in Fällen komplexer Multiresistenz als Mittel in der Salvagetherapie.
| Substanz | Handelsname | Abkürzung | Hersteller | |
|---|---|---|---|---|
| Atazanavir | Reyataz® | ATV | Bristol-Myers Squibb | |
| Fos-Amprenavir | Telzir® | fAPV | GlaxoSmithKline | |
| Darunavir | Prezista® | DRV | Janssen-Cilag | |
| Indinavir | Crixivan® | IDV | MSD | |
| Lopinavir | Kaletra® | LPV/r | Abbott | |
| Nelfinavir | Viracept® | NLV | Hoffmann-La Roche | |
| Ritonavir | Norvir® | RTV | Abbott | |
| Saquinavir | Invirase® | SQV | Hoffmann-La Roche | |
| Tipranavir | Aptivus® | TPV | Boehringer Ingelheim |
Klasseneffekte
Allen PI ist der Leber-Metabolismus gemeinsam. Ebenso ist die Erreichung von therapeutisch sicheren Plasmaspiegeln von einer Hemmung dieses Lebermetabolismus abhängig (Booster-Prinzip). Durch die Komedikation mit Ritonavir in kleiner Dosis wird eine Blockade des Cyp p450 Isoenzyms 3A4 erreicht, was zu therapeutischen PI-Spiegeln führt. Der Nachteil dieses Prinzips liegt im Interaktionspotenzial mit einer Vielzahl weiterer Medikamente aus verschiedenen Indikationsbereichen. Da inzwischen zu nahezu allen Interaktionsmöglichkeiten Studien und Erfahrungen vorliegen, können mögliche Interaktionen bei einer Interaktionsdatenbank (z.B. www.hiv-druginteractions.org) überprüft werden.
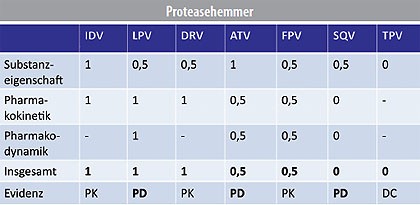 Tab. 1 CPE-Score nach Letendre5, 11
Tab. 1 CPE-Score nach Letendre5, 11
Zu
den meisten Substanzen liegen keine pharmakodynamischen Daten vor. Pharmakodynamische Daten haben in der Regel keinen
Einfluss auf die pharmakokinetische Kategorisierung.
Eine weitere pharmakologische Gemeinsamkeit der PI liegt in der geringen ZNS-Penetration. Dennoch erreichen bei voll empfindlichem Virus einige Substanzen eine wirksame Konzentrationen.5 In Tabelle 1 werden die diesbezüglichen Eigenschaften in der Darstellung von Letendre gegenübergestellt.
Bei Patienten, die eine PI-haltige ART erhalten, wurde über periphere Insulinresistenz, pathologische Glucosetoleranz, neu aufgetretenen Diabetes und über die Verschlechterung der Einstellung eines bestehenden Diabetes berichtet. Auch hierbei scheint es sich um einen Gruppeneffekt zu handeln, der alle PI betrifft.
Für alle PI wird in den Fachinformationen auf eine mögliche Veränderung des Gerinnungsvermögens hingewiesen.1, 2, 10, 18, 21 Dies ist insbesondere bei der Behandlung von Blutern zu beachten. Hier kann die erforderliche Gerinnungsfaktoren-Substitution steigen.
Saquinavir (Invirase®, SQV)
Saquinavir wurde in Deutschland erstmals 1996 als Hartkapsel zugelassen. Später folgte eine Gelkapselformulierung. Aktuell werden die 500 mg-Tabletten verwendet. Die Tagesdosis beträgt 2x 1.000 mg unter Zugabe von 2x 100 mg Ritonavir als Booster.
Die Vorteile von Saquinavir liegen in der relativ niedrigen Frequenz von subjektiven Nebenwirkungen und in der seit 17 Jahren bewährten Effektivität. Nachteil ist die hohe Tablettenzahl (drei PI-Tabletten zwölfstündlich plus zwei weitere Komponenten, z.B. Nukleosidkombinationspräparat). Die häufigsten Nebenwirkungen betreffen den Magen-Darm-Trakt und manifestieren sich beispielsweise als Völlegefühl, Übelkeit oder Diarrhoe.3, 4, 6, 18, 22
Fosamprenavir (Telzir®, FPV)
Bei Fosamprenavir handelt es sich um eine Fortentwicklung des PI Amprenavir. Die Einführung erfolgte in Deutschland 2004. Die Tagesdosis von FPV beträgt 1.400 mg, nach deutscher Zulassung 2x 700 mg mit jeweils 100 mg RTV als Booster. Die Einnahme kann mit oder ohne Nahrung erfolgen. FPV ist für PI-naive Patienten in den USA auch ohne Ritonavir-Booster zugelassen (Dosis 2x 1.400 mg gemäß US-FPI [full prescribing information FPI]). Dies ist für Patienten mit eindeutiger Ritonavir-Unverträglichkeit eine Ausweichmöglichkeit, in Deutschland allerdings „off label“. In Studien waren die häufigsten Nebenwirkungen Diarrhoe, Übelkeit, Kopfschmerzen und Hautausschläge.7, 8, 21
Lopinavir (Kaletra®, LPV)
Die Besonderheit von Lopinavir, das seit dem Jahr 2000 zugelassen ist, liegt in der fixen Ko-Formulierung mit Ritonavir. Dies ist erklärbar durch die Tatsache, dass beide Substanzen vom selben Hersteller entwickelt wurden. Die Dosis für LPV/r beträgt 400/100 mg alle 12 Stunden oder 800/200 mg einmal in 24 Stunden, d.h. 4 Tabletten der Stärke 200/50 mg pro Tag. In Studien standen an häufigeren Nebenwirkungen im Vordergrund: gastrointestinale Störungen (Übelkeit, Durchfall) und Erhöhung der Blutfette, insbesondere der Triglyzeride.1, 3, 7, 12, 13, 14, 16, 22
Atazanavir (Reyataz®, ATV)
ATV war der erste PI, der bereits primär für die einmal tägliche Anwendung entwickelt und zugelassen wurde. Während in USA auch die ungeboosterte Form zugelassen und gebräuchlich ist, ist bei uns nur das RTV-geboosterte ATV zugelassen. Die Dosis beim normalgewichtigen Erwachsenen beträgt 300 mg einmal täglich zusammen mit 100 mg RTV. Im Gegensatz tu SQV, APV und LOP beträgt hier die RTV-Boosterdosis also nur die Hälfte. Eine spezifische und reversible Nebenwirkung von ATV ist die mögliche Erhöhung des Bilirubins durch eine Konjugationshemmung. Nur in einem geringen Prozentsatz der Patienten führte dies allerdings zum Therapieabbruch, z.B. wegen einer subjektiven Störung durch einen Sklerenikterus.2, 13, 14, 15, 17, 19, 20
Darunavir (Prezista®, DRV)
Die Entwicklung von Darunavir stand zunächst unter dem Eindruck der Wirksamkeit bei mehrfachen Resistenzmutationen von vorbehandelten Patienten mit PI-Kreuzresistenzen. Später (2009) erfolgte jedoch zusätzlich die Zulassung für die Ersttherapie.
Für beide Indikationen bestehen unterschiedliche Dosierungsangaben. In der Firstline werden 800 mg DRV/100 mg RTV einmal täglich empfohlen, bei der Folgetherapie beträgt die Dosierungsrichtlinie 2x 600 mg DRV / 100 mg RTV.
Die Verträglichkeit von DRV gilt als relativ gut. Zu den häufigsten Nebenwirkungen gehören gastrointestinale Störungen, Hautausschlag, Kopfschmerz und Dyslipidämie.10, 12, 23
Auswahl des Proteaseinhibitors
Die hier aufgeführten PI zeigen in der Firstline eine sichere antivirale Wirkung. In den zahlreichen Vergleichsstudien wurden zum Teil Nicht-Unterlegenheit und zum Teil geringe Überlegenheiten im virologischen Ansprechen gezeigt. Im klinischen Alltag spielen jedoch eine ganze Reihe anderer Faktoren für die differenzialtherapeutische Auswahl einer Substanz eine große Rolle. Viele dieser Faktoren sind in der Tabelle wiedergegeben und mögen bei der individuellen Auswahl mit Blick auf die besonderen Eigenschaften des Patienten hilfreich sein. Alle Informationen stammen aus aktuell verfügbaren Fachinformationen und FPI (US-full prescribing information) (Tab. 2).
| Saquinavir | Fosamprenavir | Lopinavir | Atazanavir | Darunavir | |
|---|---|---|---|---|---|
| Tablettenzahl inclusive Booster / Tag | 6 |
4 |
4 |
2 |
3 |
| Standard-Dosierung | 2 x 1.000 mg | 2 x 700 mg | 2 x 400 / 100 mg* | 1 x 300 mg | 1 x 800 mg** |
| empfohlene Tages-Dosis Ritonavir-Booster | 200 mg | 200 mg | in Kaletra® enthalten | 100 mg | 100 mg** |
| Einnahme nüchtern vs. Mahlzeit | „sollte während odernach einer Mahlzeiteingenommen werden” | „Telzir®-Tabletten können mit oder unabhängig von den Mahlzeiten eingenommen werden” | unabhängig* | mit Mahlzeit empfohlen | „mit dem Essen ”empfohlen bzw. „innerhalb von 30 Min. nach Beendigung einer Mahlzeit” |
| kontraindiziert bei PPI | nein | nein | nein | ja |
nein |
| Einmal tägliche Gabe möglich nach Zulassung | nein | nein | ja | ja | ja |
| ZNS Gängigkeit („overall" CPE-score) | 0 | 0,5 | 1 | 0,5 | 1 |
| Exanthemhäufigkeit | 3,4% (1) | 8% (2); bei Sulfa-Allergie möglich (Kreuzallergie) | 2% (3) | 7% (4) | 10,3% (5) (DRVenthält Sulfa-Gruppe; Vorsicht bei bekannter Sulfonamid-Allergie) |
| Interaktionspotenzial mit ... | Efavirenz: erhöhte Lebertoxizität | Raltegravir: RGV AUC ca.50% erniedrigt | Colchizin:Colchizin AUC3fach erhöhtdurch Kaletra® | Tenofovir AUC durchATV um 37% erhöht; Didanosin: ATV AUCum 34-80% reduziert | Rilpivirin AUC durchDRV um 130% erhöht |
| als Saft verfügbar | nein | ja (Suspension) | ja (Lösung, auch überSonde applizierbar) | nein | ja (Suspension) |
| Kinderzulassung | nein | ab 6 Jahre | >2 Jahre | ab 6 Jahre | ab 3 Jahre |
| Zulassung ohne Booster | nein | nur USA | nein | nur USA | nein |
| Nierenfunktionseinschränkung | „Bei Patienten mit schwerer Nierenfunktionsstörung ist Vorsicht geboten” |
keine Anpassung erforderlich |
keine Anpassung erforderlich |
keine Anpassung erforderlich | keine Anpassung erforderlich |
| relevante KI | QTc-Verlängerung | HMG-CoA-Reduktaseinhibitoren (Simvastatin und Lovastatin) |
Patienten mit schwerer Leberdysfunktion |
Simvastatin, Lovastatin | HMG-CoA-Reduktaseinhibitoren (Simvastatinund Lovastatin) |
| Herzinsuffizienz | Antiarrhythmika (Amiodaron, Bepridril) | ||||
| Arrythmie | Chinidin, systemisches Lidocain | ||||
| besonderer Hinweis | vor Therapie EKG zur QTc-Bestimmung erforderlich; (6) |
sollte bei bekannter Sulfonamidallergie mit Vorsicht angewendet werden |
QTc-Verlängerung möglich |
Vorsicht bei „Patienten mit vorbestehenden Risikofaktoren (Bradykardie, kongenitale QTc-Verlängerung, Elektrolyt-Imbalance)” | Salmeterol-Inhalation: QTc-Verlängerung (7) |
| NW „sehr häufig” lt. Fachinformation | Diarrhöe, Übelkeit | Diarrhöe | Diarrhöe, Übelkeit | reversible Erhöhungdes indirekten (unkonjugierten) Bilirubins, bedingt durch Hemmung der UDPGlucuronyltransferase | Diarrhöe |
| Transaminasenerhöhung | Cholesterinerhöhung | Erbrechen | |||
| Cholesterinerhöhung | Cholesterinerhöhung | ||||
| Triglyceriderhöhung | Triglyceriderhöhung | ||||
| Thrombopenie | |||||
| Stand der Information lt. FI | Aug 12 | Mai 11 | Feb 12 | Aug 12 | Okt 12 |
|
* Einmaldosierung von 800 / 200 mg (=4 Tabletten) ist möglich, mit Mahlzeit empfohlen ** bei vorbehandelten Patienten mit VL>100.000 und/oder Resistenzmutationen Dosierung 2x 600 mg / 100 mg |
1 Studie MaxCMin1 lt FPI Invirase 2012 2 Studie APV30001 lt FPI Lexiva 2012 3 Studie 888 lt FPI Kaletra 2012 4 Studie AI424-034 lt FPI Reyataz 2012 5 Studie C211 lt FPI Prezista 2012 |
6 FI: „Der Arzt sollte nachfragen, ob plötzliche Todesfälle bei jungen Angehörigen in der Familienanamnese bekannt sind, da dies auf eine kongenitale QTc-Verlängerung hindeuten kann“ |
7 FI: „Die gleichzeitige Anwendung von Salmeterol und PREZISTA mit niedrig dosiertem Ritonavir wird nicht empfohlen. Die Kombination kann zu einem erhöhten Risiko für kardiovaskuläre Nebenwirkungen mit Salmeterol, einschließlich QTc-Verlängerung, Palpitationen und Sinustachykardie führen“ |
Tab. 2 Differenzialindikation Proteasehemmer in der Firstlinetherapie
günstige
Eigenschaft Einschränkung ungünstige Eigenschaft
1 Abbott (2012) Fachinformation Kaletra 200 mg/50 mg Filmtabletten. Fachinfoservice Rote Liste
2 Bristol-Myerssquibb (2012) Fachinformation REYATAZ® 150 mg/- 200 mg/- 300 mg Hartkapseln. Fachinfoservice Rote Liste
3 Bunupuradah T, Kosalaraksa P, Puthanakit T et al. (2011) Monoboosted lopinavir/ritonavir as simplified second-line maintenance therapy in virologically suppressed children. AIDS 25:315-323
4 Cameron DW, Japour AJ, Xu Y et al. (1999) Ritonavir and saquinavir combination therapy for the treatment of HIV infection. AIDS 13:213-224
5 Capparelli EV, Holland D, Okamoto C et al. (2005) Lopinavir concentrations in cerebrospinal fluid exceed the 50% inhibitory concentration for HIV. AIDS 19:949-952
6 Collier AC, Coombs RW, Schoenfeld DA et al. (1996) Treatment of human immunodeficiency virus infection with saquinavir, zidovudine, and zalcitabine. AIDS Clinical Trials Group. N Engl J Med 334:1011-1017
7 Eron J, Jr., Yeni P, Gathe J, Jr. et al. (2006) The KLEAN study of fosamprenavir-ritonavir versus lopinavir-ritonavir, each in combination with abacavir-lamivudine, for initial treatment of HIV infection over 48 weeks: a randomised non-inferiority trial. Lancet 368:476-482
8 Gathe JC, Jr., Ive P, Wood R et al. (2004) SOLO: 48-week efficacy and safety comparison of once-daily fosamprenavir /ritonavir versus twice-daily nelfinavir in naive HIV-1-infected patients. AIDS 18:1529-1537
9 Hoffmann C (2012) Was schief gehen kann, geht schief - oder: ein Plädoyer für Proteasehemmer. Hiv&more 8
10 International J-C (2012) Fachinformation PREZISTA® 400 mg Filmtabletten. Fachinfoservice Rote Liste
11 Letendre S (2012) CPE Tabulation Protease Inhibitors (slide 14/29). In:
12 Mills AM, Nelson M, Jayaweera D et al. (2009) Once-daily darunavir/ritonavir vs. lopinavir/ritonavir in treatment-naive, HIV-1-infected patients: 96-week analysis. AIDS 23:1679-1688
13 Molina JM, Andrade-Villanueva J, Echevarria J et al. (2008) Once-daily atazanavir/ritonavir versus twice-daily lopinavir/ritonavir, each in combination with tenofovir and emtricitabine, for management of antiretroviral-naive HIV-1-infected patients: 48 week efficacy and safety results of the CASTLE study. Lancet 372:646-655
14 Molina JM, Andrade-Villanueva J, Echevarria J et al. (2010) Once-daily atazanavir/ritonavir compared with twice-daily lopinavir/ritonavir, each in combination with tenofovir and emtricitabine, for management of antiretroviral-naive HIV-1-infected patients: 96-week efficacy and safety results of the CASTLE study. J Acquir Immune Defic Syndr 53:323-332
15 Moyle GJ, Andrade-Villanueva J, Girard PM et al. (2012) A randomized comparative 96-week trial of boosted atazanavir versus continued boosted protease inhibitor in HIV-1 patients with abdominal adiposity. Antivir Ther 17:689-700
16 Murphy RL, Brun S, Hicks C et al. (2001) ABT-378/ritonavir plus stavudine and lamivudine for the treatment of antiretroviral-naive adults with HIV-1 infection: 48-week results. AIDS 15:F1-9
17 Puls RL, Srasuebkul P, Petoumenos K et al. (2010) Efavirenz versus boosted atazanavir or zidovudine and abacavir in antiretroviral treatment-naive, HIV-infected subjects: week 48 data from the Altair study. Clin Infect Dis 51:855-864
18 Roche (2012) Fachinformation INVIRASE® 500 mg Filmtabletten. Fachinfoservice Rote Liste
19 Soriano V, Arasteh K, Migrone H et al. (2011) Nevirapine versus atazanavir/ritonavir, each combined with tenofovir disoproxil fumarate/emtricitabine, in antiretroviral-naive HIV-1 patients: the ARTEN Trial. Antivir Ther 16:339-348
20 Vernazza P, Daneel S, Schiffer V et al. (2007) The role of compartment penetration in PI-monotherapy: the Atazanavir-Ritonavir Monomaintenance (ATARITMO) Trial. AIDS 21:1309-1315
21 Viiv_Healthcare (2011) Fachinformation Telzir® 700 mg Filmtabletten. Fachinfoservice Rote Liste
22 Walmsley S, Avihingsanon A, Slim J et al. (2009) Gemini: a noninferiority study of saquinavir/ritonavir versus lopinavir/ritonavir as initial HIV-1 therapy in adults. J Acquir Immune Defic Syndr 50:367-374
23 Young J, Scherrer AU, Gunthard HF et al. (2011) Efficacy, tolerability and risk factors for virological failure of darunavir-based therapy for treatment-experienced HIV-infected patients: the Swiss HIV Cohort Study. HIV Med 12:299-307










 Diese Seite weiter empfehlen
Diese Seite weiter empfehlen
